Morfogenesi e citotossicità dei granuli di lipofuscina
Osservazioni morfologiche sui casi di meningioma
Prof. Luigi Cuccurullo
Emerito di Anatomia Patologica
La lipofuscina è un materiale che si forma e si accumula nell’interno delle cellule in modo progressivo fino a determinarne la lisi. Tale processo può manifestarsi, in condizioni di fisiologia e di varia patologia in diversi tipi di cellule; in modo elettivo si riscontra in cellule di soggetti di età avanzata e pertanto i depositi di lipofuscina sono definiti “il pigmento della senescenza”.
La sintesi di questo materiale negli organi è apparentemente casuale e le cellule interessate appaiono ingrandite, ovoidali e mostrano un citoplasma omogeneo, compatto di colore “giallo brunito”.
Quando i depositi di lipofuscina sono estesi e molto densi, il reperto è apprezzabile anche all’esame macroscopico dei tessuti o dei visceri colpiti per il formarsi di chiazze di colore giallo-brunito.
Questo materiale è stato da sempre considerato “inerte” ed è ritenuto essere un prodotto di alterazioni di tipo degenerativo del metabolismo cellulare.
E’ stato anche accertato che i granuli di lipofuscina sono insolubili e non degradabili mediante gli enzimi endocellulari e la loro comparsa viene correlata al grado del danno ossidativo delle proteine, alla alterata funzionalità dei mitocondri, alla inefficienza dei sistemi proteasomici ed autofagico-lisosomiali. (Ann NY Acad Sci; 2007; 1119: 97-111).
Per meglio conoscere la natura e la morfogenesi di questo materiale sono state eseguite anche ricerche di biochimica e di morfologia ultrastrutturale supportate anche da indagini sperimentali mediante lipofuscina artificiale. I risultati delle ricerche di biochimica hanno permesso di affermare che i granuli di lipofuscina sono formati da proteine ossidate, da lipidi e da zuccheri. (Free Radic. Biol. Med. 2011; 50: 585-591).
I dati morfogenetici attualmente acquisiti, indicano essere i granuli di lipofuscina degli inclusi citoplasmatici in conseguenza di un disordine dell’omeostasi delle proteine. (Bull Acad Nath. Med. 2012; 196: 1575-1585). Questa omeostasi è regolata da un continuo bilanciamento tra quote di proteine sintetizzate e quote di proteine degradate.
Questo processo di degradazione riguarda non solo le proteine normali ma anche quelle “unfolded”,quelle danneggiate oppure ossidate. Questa omeostasi è affidata ai sistemi lisosomiali e proteasomici i quali, se insufficienti, o danneggiati possono essere una causa determinante per uno squilibrio della omeostasi delle proteine. (JUBMB Life, 2009; 61: 522-527) (Mol Aspects Med, 2009; 30: 191-226) (Exp Oncol 2012; 34: 286-297).
In conseguenza di stress di vario genere si ha attivazione dei sistemi proteasomici e lisosomiali per mantenere in omeostasi il turnover delle proteine; se si hanno alterazioni di questi sistemi, il turnover si rallenta o si arresta con conseguente accumulo di proteine ossidate con effetti citotossici. (Int. J. Bichem. Cell Biol, 2004; 36: 2376-2391)(Mol Aspects Med, 2009; 30: 191-226).
Si ritiene che queste proteine ossidate derivanti dal cytosol e dagli organelli alterati commisti a lipidi, non sottoposti a processi di proteolisi, si depositino nei lisosomi e questi accumuli siano la fase finale di tale processo di degradazione di proteine ossidate; questi cumuli si accrescono e si addensano come materiale idrofobo nel tempo in quanto non sono degradati dagli enzimi lisosomiali (Redox Biol 2013; 1: 140-144).
A conclusione di tali interpretazioni,il progressivo accumularsi di tale materiale proteico,aggregandosi, viene indicato come granuli di lipofuscina.
Alla luce delle nuove acquisizioni,esso non viene considerato sostanza inerte ma svolge attività citotossica, poiché incorpora rame, ferro,e induce un aumento dei radicali liberi,una ossidazione dei lipidi, delle proteine, del RNA/DNA. (Free Radic Biol. Med. 2010; 48: 1100-1108) (Redox Biol. 2017; 11: 673-81)
I depositi di lipofuscina riscontrati in alcuni casi nei meningiomi meningoteliali e qui di seguito illustrati non hanno alcun significato oncologico,ma sono utilizzati quali reperti per contribuire alla conoscenza della morfogenesi di questo materiale e la sua eventuale capacità citotossica,mediante le acquisizioni della microscopia elettronica.
In particolare si pongono i seguenti due interrogativi:
1 La sede intracitoplasmatica a livello della quale si formano i granuli di lipofuscina
2 Eventuale citotossicità svolta direttamente dai granuli lipofuscina
REPERTI
Nel contesto di una popolazione cellulare meningoteliale di media densità, ben differenziata, e caratterizzata da elementi ovoidali o irregolarmente fusati, i quali sono forniti di ampio citoplasma e nucleo normo-cromatinico, si repertano altri aventi il citoplasma ricolmo di materiale finemente granuloso,di colore giallo-brunito.
Fig.1 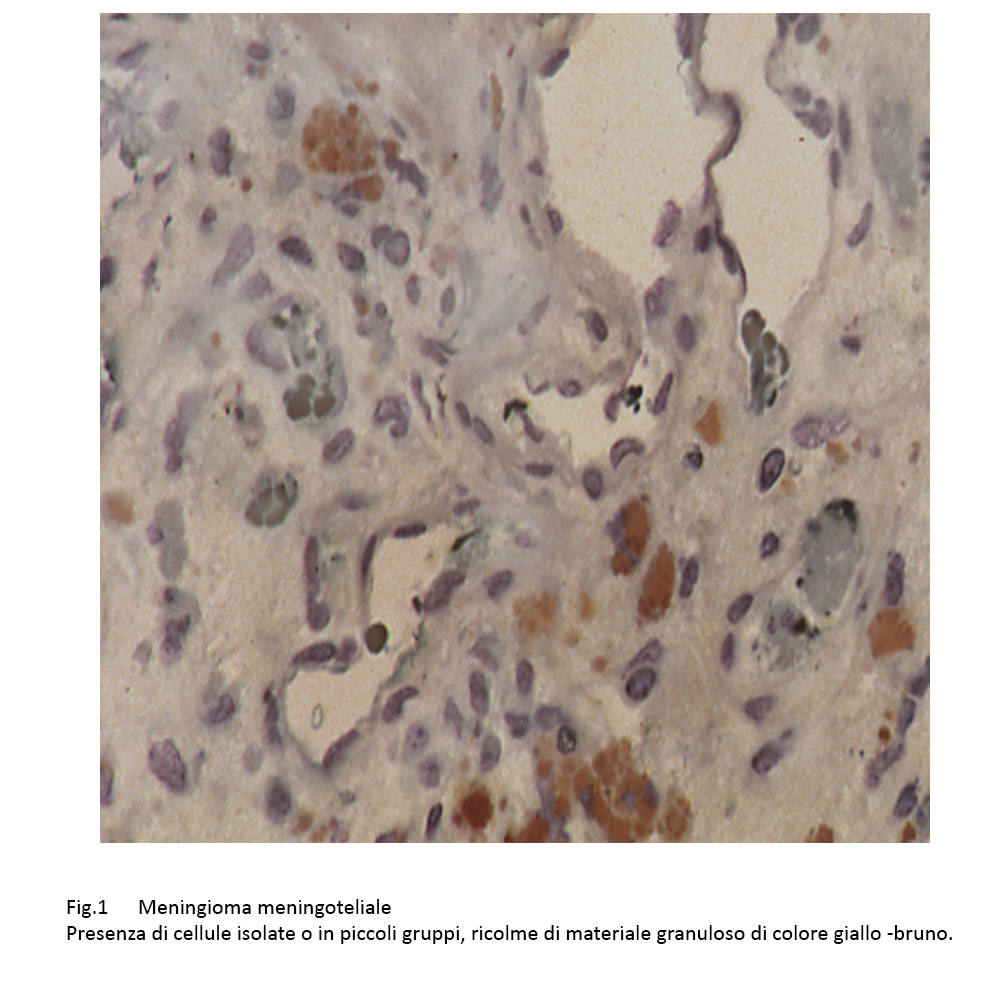
Queste cellule hanno un ampio citoplasma, hanno un nucleo marginato alla periferia o mascherato dal materiale accumulato e sono distribuite nel contesto della neoplasia in modo apparentemente casuale, quali elementi singoli o riuniti a piccoli gruppi senza alcuna coesione intercellulare.
Fig.2 
Alcune, eccessivamente ingolfate di tale materiale mostrano lacerazioni della membrana plasmatica e di conseguenza uno sversamento del contenuto negli spazi intercellulari.
La presenza di questo materiale “estraneo” in tali spazi induce una reazione flogistico-mesenchimale rappresentata dalla attivazione di cellule macrofagiche e dall’arrivo di elementi flogistici mnonucleati.
Fig.3  Fig.4
Fig.4 
Le osservazioni condotte al microscopio elettronico hanno evidenziato granuli di lipofuscina anche nel citoplasma di cellule valutate come indenni al microscopio luce.
In questi elementi si repertano microgranuli di lipofuscina nel citosol e nelle cisterne del reticolo endoplasmico; essi mostrano un aspetto più compatto e hanno dimensioni superiori ai ribosomi.
Fig.5 
Sono state riscontrate altre cellule similari le quali contengono nel citosol granuli più voluminosi, quali espressioni di una aggregazione di quelli più minuti.
La presenza così esigua del suddetto materiale non compromette l’assetto strutturale del citoplasma, ma si associa soltanto a una rarefazione del citosol,a una coartazione mitocondriale,a una dilatazione delle cisterne del reticolo endoplasmico,a un aumento della componente del citoscheletro.
Fig.6 

A contrario,i reperti riguardanti le cellule infarcite di lipofuscina ( identificati al microscopio luce) sono molto diversi in quanto sono destrutturanti fino alla cito-necrosi.
Per chiarezza e semplicità espositiva è opportuno suddividere tale documentazione secondo gradi:
Il primo è dato da cellule contenenti nel citosol granuli di diversa grandezza e grossi coacervi raccolti in escavazioni prive di pareti proprie; coesistono nell’ambito delle stesse aree citoplasmatiche foci di micro-necrosi
Fig.7 

Fig.8 

Fig.9  Fig.10
Fig.10 
Fig.11  Fig.12
Fig.12 
e voluminosi autofagolisosomi ricolmi di questo materiale, delimitati da strati concentrici di fibrille e contornati di altri piccoli,similari focolai satelliti.
Fig.13  Fig.14
Fig.14 
In queste cellule la microstruttura del citoplasma è sovvertita o cancellata; infatti non sono repertabili mitocondri, ergastoplasma, reticolo endoplasmico, apparato del Golgi, etc. ma solo uno stato di fibrille di vario spessore riferibili a iperplasia del citoscheletro.
Fig.15  Fig.16
Fig.16 

Fig.17 
Il secondo grado, peggiorativo rispetto al precedente, si rappresentato da cellule con un citoplasma interamente occupato da aggregati compatti di ammassi iperdensi e compatti di lipofuscina con cancellazione di ogni sub-struttura citoplasmatica. Il progressivo aumento di tali depositi provoca la frammentazione della membrana plasmatica e loro svuotamento negli spazi intercellulari.
Fig.18  Fig.19
Fig.19 
Commento
Queste osservazioni descrittive su la morfogenesi e citotossicità della lipofuscina possono dare un contributo alla conoscenza di tale complesso processo. Esse consentono di elaberare come risposte attendibili agli interrogativi dianzi proposti:
1 La sede di formazione di questo materiale,da quanto si riscontra al microscopio elettronico è rappresentata dalle cisterne del reticolo endoplasmico. Infatti, è stato documentata la presenza di granuli minimi di tale composto nelle cisterne del reticolo endoplasmico e nel citosol.
Questi granuli minimi si accrescono localizzandosi in un contesto nel quale gli organelli intracitoplasmatici mostrano segni di sofferenza e di disfunzione (mitocondri coartati, reticolo endoplasmico con cisterne ectasiche in stato di stress). Essi si accrescono per apposizione di altro materiale o per fusione di granuli contigui, acquistando una forma irregolarmente rotondeggiante o come conglomerati dismorfi.
.Si ritiene che tali granuli si raccolgono inizialmente nel citosol e successivamente in una fase secondaria si ha accumulo nel sistema autofago-lisosomiale,quale luogo di deposito per ridurre la tossicità di tale prodotto. Questo accumulo può essere considerato la fase finale di un danno endocellulare indotto da uno stato di stress.(Free Radic.Biol.Med. 2012;53:1760-17) ( Redox Biology 2013;1:140-144)
In modo contestuale si osserva una cancellazione degli organelli citoplasmatici e in sostituzione si nota una marcata iperplasia del citoscheletro con sovvertimento strutturale del citosol.
Un’ulteriore accumularsi di lipofuscina induce lo scoppio degli autofagolisosomi, la frammentazione delle fibrille del citoscheletro e della membrana plasmatica. Il materiale così conglomerato si ritrova in sede extra cellulare, come corpo estraneo atto a provocare una risposta flogistico-macrofagica.
Si ipotizza che una condizione di stress ossidativo induca danni bio-molecolari non riparabili dai sistemi lisosomiali,proteasomici e dalle proteasi del citosol; alla base,quindi,vi è uno stress cellulare che avvia la formazione di proteine ossidate le quali non subiscono proteolisi,ma si coniugano con altre formando corpi idrofobi. L’accumulo di lipofuscina è conseguente al blocco dell’autofagia e del sistema di fusione autofago-lisosomiale con impossibilità degli enzimi lisosomiali a degradare tali molecole.(Arch.Biochem.Biophys. 2007;462:220-230) (Redox Biol.2013;263:140-144)
2 I reperti morfologici qui acquisiti non sono indicativi di una citotossicità da molecole attive, atte a provocare in via diretta processi degenerativi o necrotici.
I reperti ultrastrutturali osservati lasciano ritenere che le molecole di lipofuscina, non degradabili degli enzimi lisosomiali, si accumulino in modo progressivo e in quanto materiale”estraneo” provocando danni irreversibili,e progressivi fino alla citolisi del bio-sistema.
