Università degli Studi della Campania
Luigi Vanvitelli
L’autofagia nei meningiomi benigni e maligni (Osservazioni ultrastrutturali) Prof. Luigi Cuccurullo EMERITO DI ANATOMIA PATOLOGICA |
Le cellule sono strutture dinamiche in un equilibrio instabile, che è regolato mediante continui processi anabolico-catabolici. Questo equilibrio, indicato come omeostasi, non è circoscritto all’ambiente endocellulare ma è esteso a quello extracellulare attraverso i flussi molecolari di endocitosi ed esocitosi. (Mol. Cell. 2010; 40: 280-93) A tutto ciò è necessario aggiungere un fattore dinamico quantitativo, ossia una omeostasi numerica per ogni tessuto e organo per evitare eccedenze cellulari capaci di alterare le normali condizioni morfo-funzionali e con esse le finalità delle strutture stesse.
La persistenza nel tempo di questi stati di equilibrio, indicati anche come normale stabilità bio-morfologica degli organi, è raggiunta mediante complesse attività biologiche quali i processi proteosomici, endo-lisosomiali, fagolisosiomiali, apoptosici e autofagici. (Cell. Res. 2012; 22: 43 – 61).
Questi meccanismi sono in continua attività e sono finalizzati non solo al ri-equilibrio delle sub-strutture cellulari in condizioni di fisiologia ma ancora di più intervengono in condizioni di varia patologia cellulare nelle fasi di acuzie e di cronicità. (Molecular Cell, 2010; 40: 280-93) (Cell 2008; 132: 27-42). Tra questi processi endocellulari,tutti finalisticamente importanti,vengono qui di seguito condotte osservazioni su focolai di autofagia lisosoma dipendente eventualmente presenti in cellule meningoteliali benigne e in cellule di meningiomi anaplastici. L’autofagia è un processo, regolato da geni, che si snoda attraverso fasi che si concludono con la degradazione lisosomiale di molecole e substrutture, fino alla riduzione delle stesse a molecole elementari (aminoacidi, acidi grassi, etc.) e loro riutilizzo per il restauro e lo sviluppo cellulare. (Molecular Cell 2010; 40: 280-93).
Sono descritti tre tipi di autofagia denominati microautofagia,macroautofagia,e autofagia chaperone dipendente. La microautofagia si forma mediante un processo attivo di invaginazione della membrana di un lisosoma mediante la quale ingloba materiale citoplasmatico che sarà successivamente degradato.(Exp.Cell Res. 1980;129:460-466). La macroautofagia (autofagia propriamente detta) è caratterizzata da un focolaio cavo,delimitato da una membrana a doppio contorno; in questo spazio cavo si raccoglie materiale amorfo e fibrillare,organuli.frammenti di citoplasma,etc.
Questo focolaio,denominato autofagosoma, con il suo cargo subisce una fusione con un lisosoma,formando così un corpo complesso denominato auto- lisosoma.(Curr.Top.Microbiol.Immunol.2009;335:1-32) Dopo la fusione e l’avvenuta formazione dell’autolisosoma,il cargo viene degradato mediante gli enzimi lisosomiali e le molecole elementari liberate sono riversate nel citosol per essere riutilizzate nei processi di biosintesi.(Cell Death Differ.2005;12:1542-52) Le fasi, dianzi ricordate, attraverso le quali si determina questo processo di macroautofagia possono essere ricondotte (per brevità) a tre:
1. La formazione di una struttura cava contenente microframmenti e organuli che è delimitata da una membrana a doppio strato; questa membrana ha la doppia funzione di contenere il materiale biologico da degradare e nel contempo di isolarlo dalla restante quota sana del citoplasma. (Autophagy 2011; 7: 279-96)
2. La fusione di questo focolaio autofagosomico con un lisosoma; conseguente commistione del contenuto sopra citato con gli enzimi idrolitici lisosomiali e successiva degradazione di tale materiale in molecole elementari.
3. Ri-utilizzo di queste molecole elementari nei processi anabolizzanti delle cellule (Autophagy 2012; 8: 794-811). L’Autofagia Chaperone mediata è un processo altamente selettivo finalizzato alla degradazione di proteine,di fattori di trascrizione e loro inibitori,di proteine leganti lipidi, di sub-unità proteosomiche,di alcuni enzimi glicolitici,etc. Questo materiale attraverso l’azione chaperone-mediata viene riversato direttamente nei lisosomi attraverso la loro membrana per essere poi degradato. Ciò avviene per il coinvolgimento da complessi di proteine chaperone,presenti nel citosol e da proteine che sono esistenti nel contesto della membrana lisosomiale. (FEBS Letters,2010;584:1399-1404) In letteratura si usano termini quali flusso autofagico o via autofagica per indicare il continuo trasporto di molecole o substrutture ai lisosomi, quali centrali biologiche finalizzate a questi processi di degradazione enzimatica.
Queste substrutture hanno una morfologia ultrastrutturale molto eterogenea in quanto è condizionata dalla fase nella quale cade l’osservazione e dal tipo di contenuto da degradare. Questi contenuti sono molto eterogenei poichè sono rappresentati sia da materiali endocellulari trasportati tramite l’autofagia sia da materiali esocellulari trasportati mediante endocitosi e fagocitosi. (Ann. NY Acad Sci, 2016; 1371:45-54). I lisosomi, sebbene siano sul piano morfologico molto vari, sono distinguibili in primari e secondari. I lisosomi primari appaiono come piccole vescicole, delimitate da una membrana a monostrato, contenente quote di materiale amorfo debolmente elettropaco. Quelli secondari sono vacuoli di diversa ampiezza e di forma irregolare, delimitati da una membrana a monostrato, contenente materiali e substrutture eterogenee in preda a livelli diversi di degradazione enzimatica. Al termine di questo processo demolitivo, i lisosomi si riducono di volume e si trasformano in “corpi residui”, rappresentati da piccole vescicole contenenti materiale amorfo e granuli di varia grandezza. L’autofagia, da quanto è riportato in letteratura, è un processo fondamentale nella economia della biologia cellulare. Nelle sue vescicole si ritrovano molecole del citosol, mitocondri disfunzionali o danneggiati, frammenti di reticolo endoplasmico in stato di stress, complessi proteici, aggregati lipidici, sostanze tossiche, agenti infettivi, sostanze esogene penetrate nel citosol, etc. Nel suo sviluppo, il focolaio autofagico non danneggia il citoscheletro della cellula, ma coinvolge tutti gli organuli che provvedono alle attività metabolico-energetiche della struttura cellulare (Autophagy 2013; 9: 403-409) (Nature 1999; 402: 672-676). Focolai di autofagia sono stati riscontrati e risultati determinanti in diverse condizioni di fisiologia e di patologia (Physiological Review, 2010; 90: 1383-1435). Tra i tanti,qui di seguito saranno ricordati solo alcuni considerati tra i più significativi:
1) L’autofagia regola i processi di differenziazione cellulare nel corso dell’embriogenesi, mentre nella vita extrauterina controlla i processi di iperplasia cellulare (J. Cell Mol. Med 2013; 17: 12-29) Interviene nei processi di adattabilità delle cellule a fronte delle mutate condizioni extracellulari, metaboliche o stressanti (Molecular Cell 2010; 40: 280-293).
2) E’ presente nei meccanismi immunitari partecipando ai complessi sistemi di difesa dalle infezioni. (Nature, 2011; 469: 323-335).
3) L’autofagia degrada, anche in condizioni di fisiologia, molecole eccedenti, superflue e svolge un controllo su tutto ciò che modifica gli indici di normalità delle funzioni cellulari. (Cell Res 2012; 22: 43-61).
4) E’ presente in modo attivo e determinante nel turnover degli organuli intracitoplasmatici; provvede ad avviare il percorso della degradazione e a rimuovere eventuali cumuli di proteine abnormi prodotte da organuli danneggiati (Protoplasma 2012; 249: 1037-47).
5) L’autofagia blocca molte malattie di tipo degenerativo e difende la struttura cellulare da stress metabolici, ossidativi, da disfunzioni dei mitocondri, da danni del reticolo endoplasmatico e nel contempo regola nei limiti della norma le attività nutrizionali delle cellule. (Genes Dev 2011; 25: 460-70) (J Cell Mol. Med. 2015; 19: 2084-97). (FEBS J. 2016; 283: 2640-523) (Cell 2011; 147: 728-41). 6) Infine,rimane aperto l’interrogativo circa la esistenza di una morte cellulare indotta da autofagia, oppure possa trattarsi di una morte cellulare associata a focolai autofagici, e quindi non causata da questi. (Cell Death Differ. 2012; 19: 87-95) (Nat. Rev. Mol. Cell. Biol. 2014; 15: 81-94). Da quanto è stato dianzi ricordato è possibile sostenere che i processi di autofagia, nelle sue varianti, occupano una posizione centrale nell’ambito della biologia cellulare sia nelle condizioni di stati di fisiologia sia in quelle più numerose e complesse degli stati di patologia cellulare. In tale ambito scientifico sono stati elaborati numerosi studi anche su i rapporti tra i processi di autofagia e quelli neoplastici, in particolare quelli maligni. Queste ricerche hanno indagato le varie fasi di sviluppo di diverse neoplasie anche in rapporto ai fattori di immuno-sorveglianza su tali processi. Questi rapporti (autofagia-oncologia) indubbiamente esistono, sono complessi, sono dinamici e il loro futuro studio richiede numerose quanto diverse metodiche tra loro integrate. Al di là di tali problematiche,nelle righe successive si vuol riportare (in una semplice dimensione descrittiva ultrastrutturale)la esistenza di focolai di autofagia in un tumore benigno,quale il meningioma meningoteliale e la loro assenza nella corrispettiva forma anaplastica.
A) FOCOLAI DI AUTOFAGIA NEI MENINGIOMI MENINGOTELIALI BENIGNI
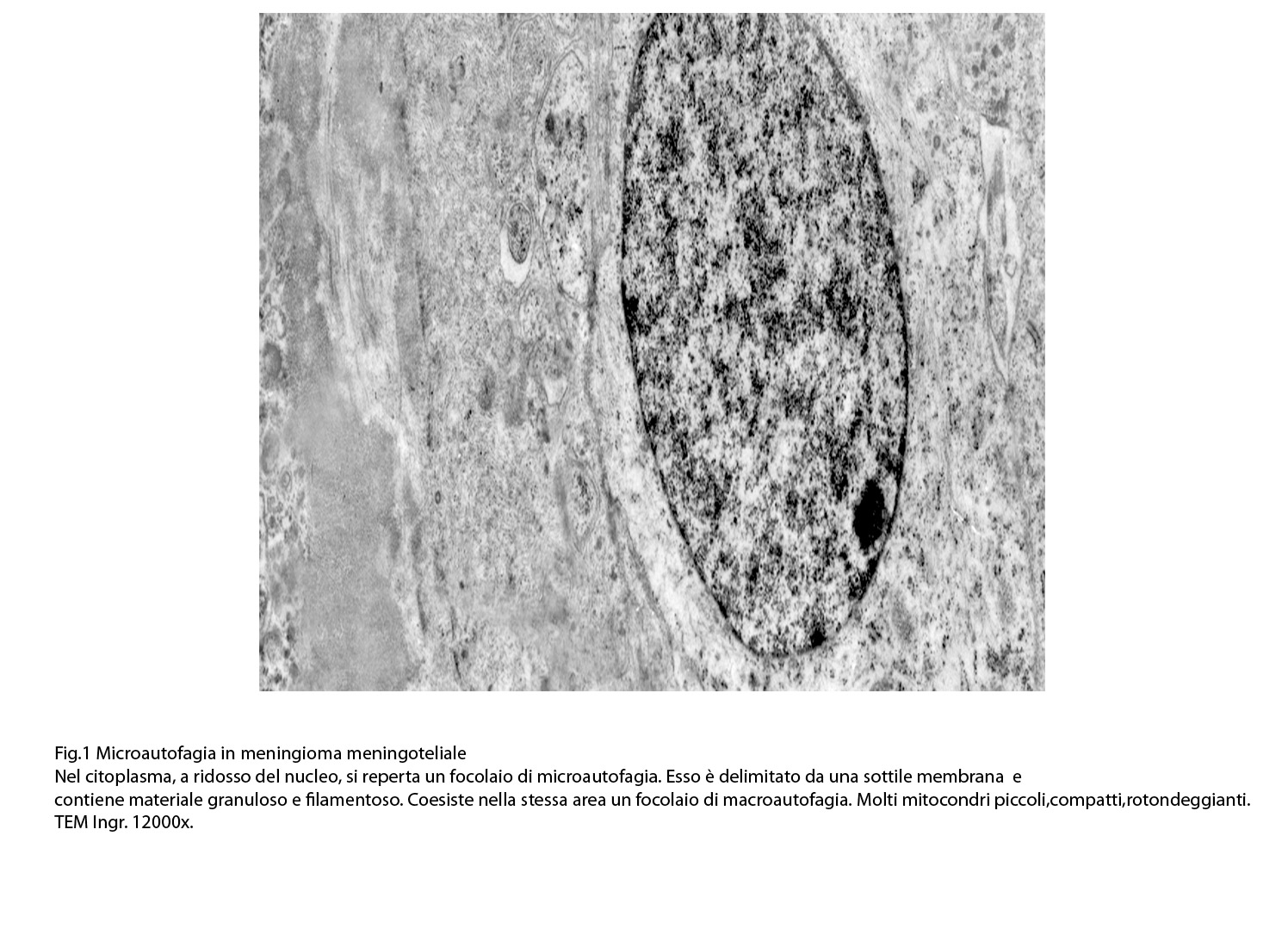
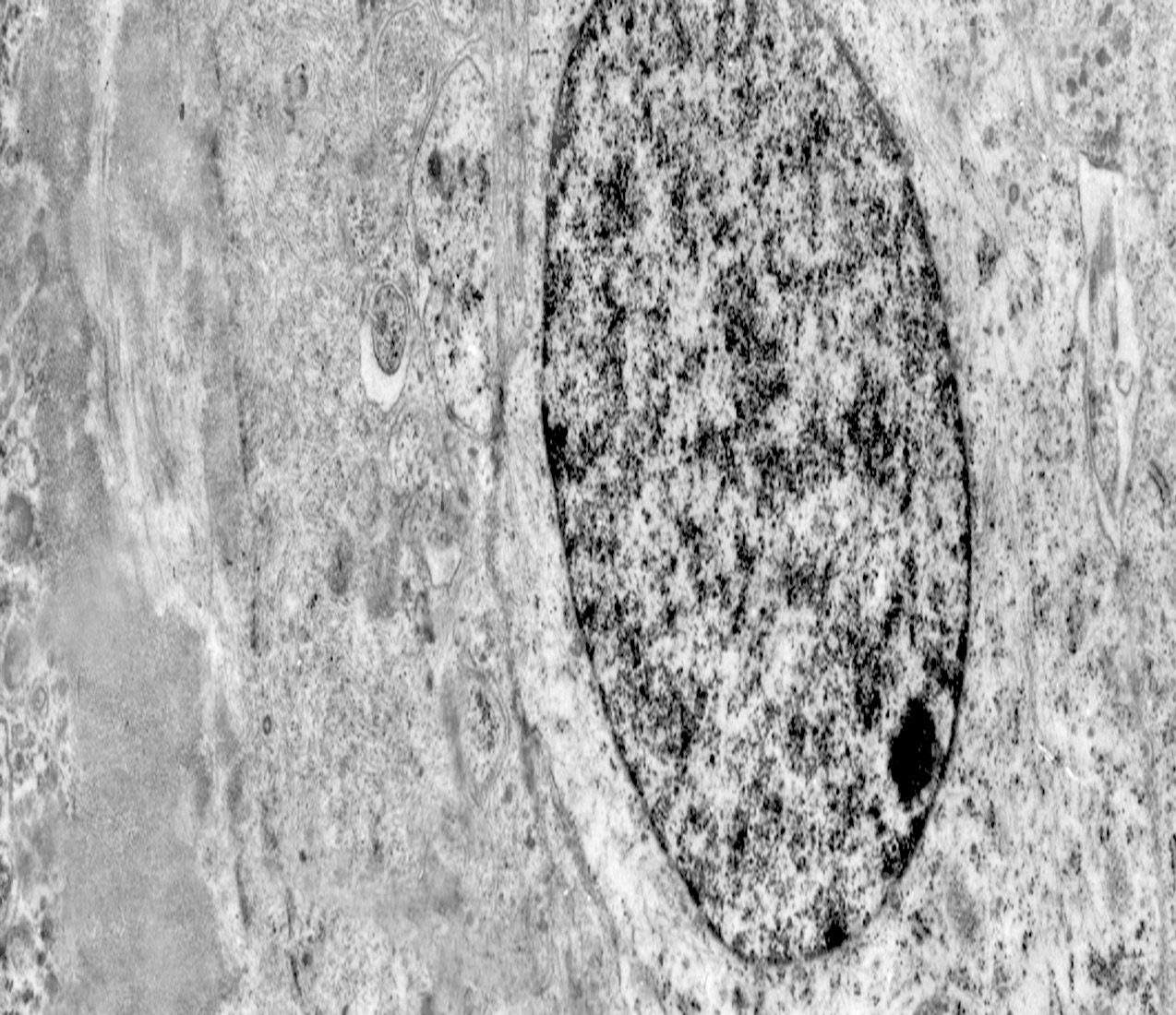
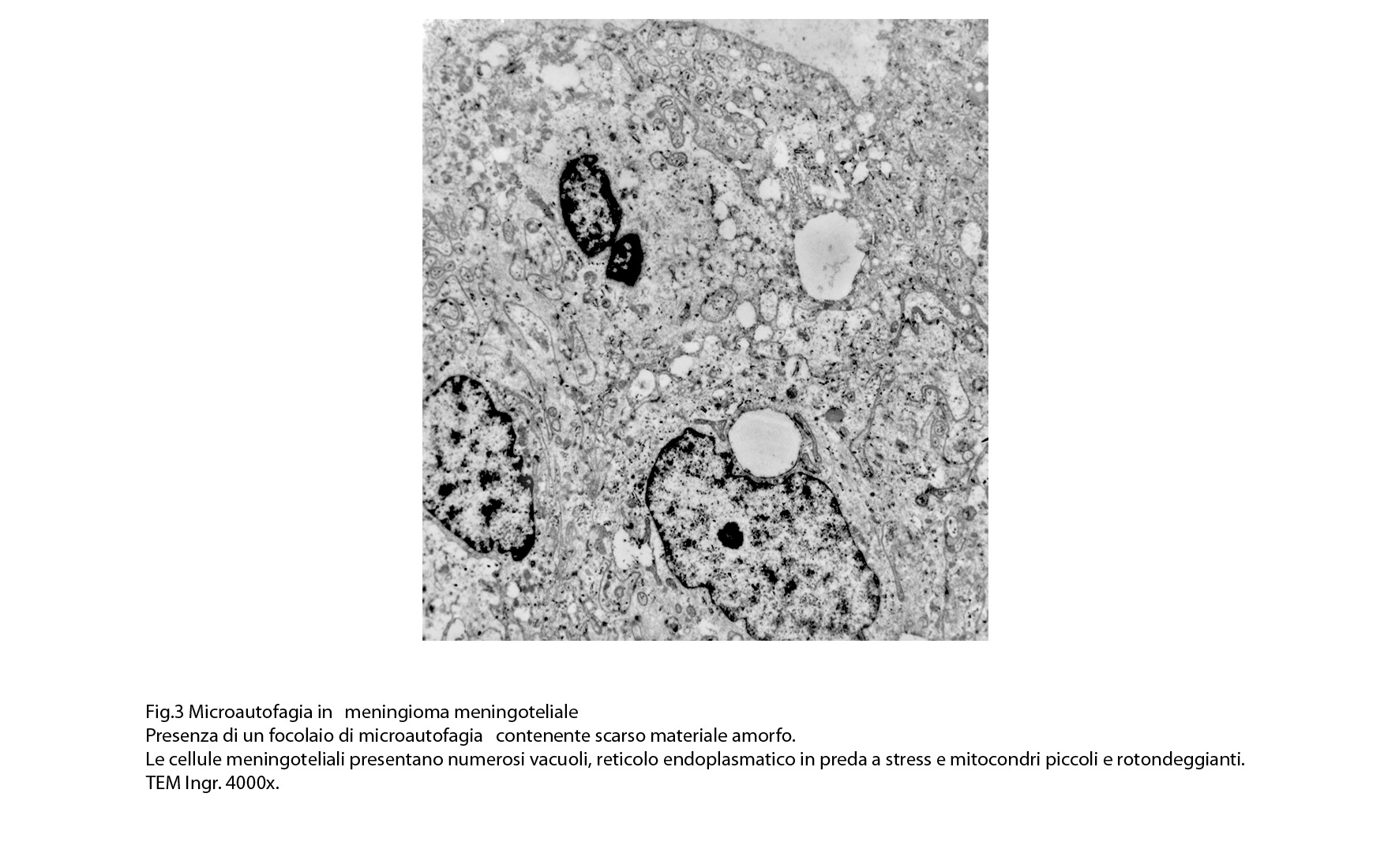
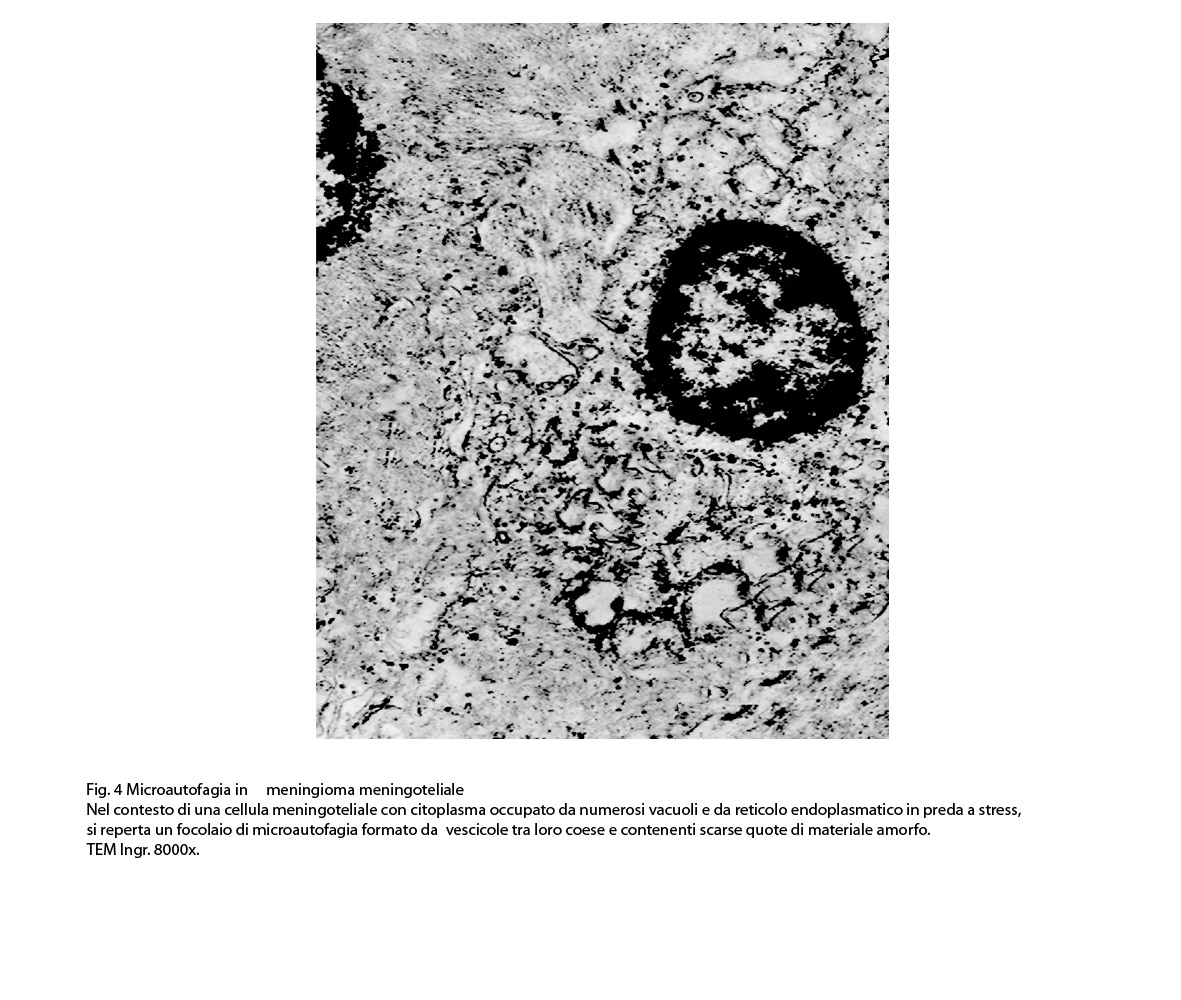
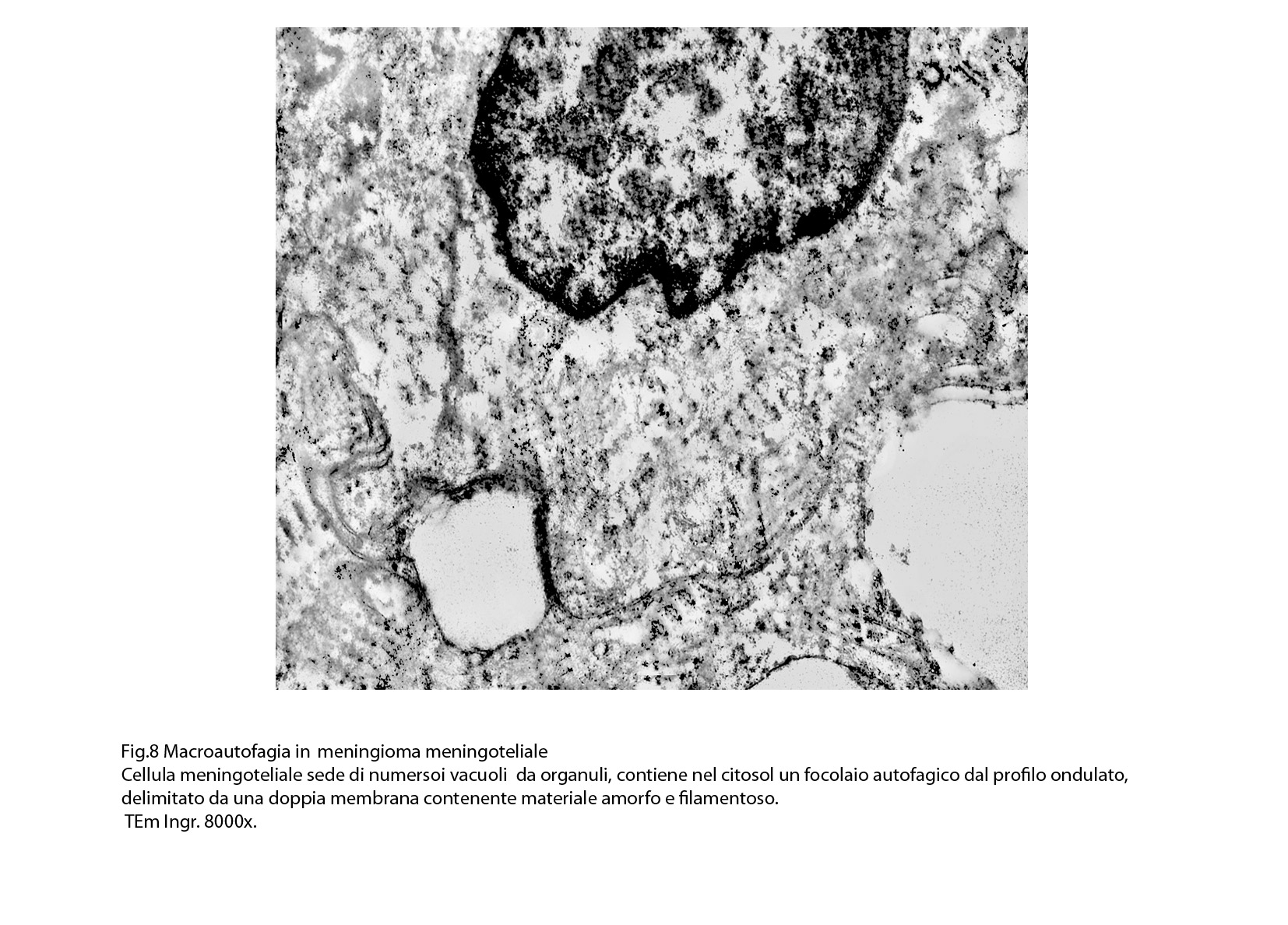
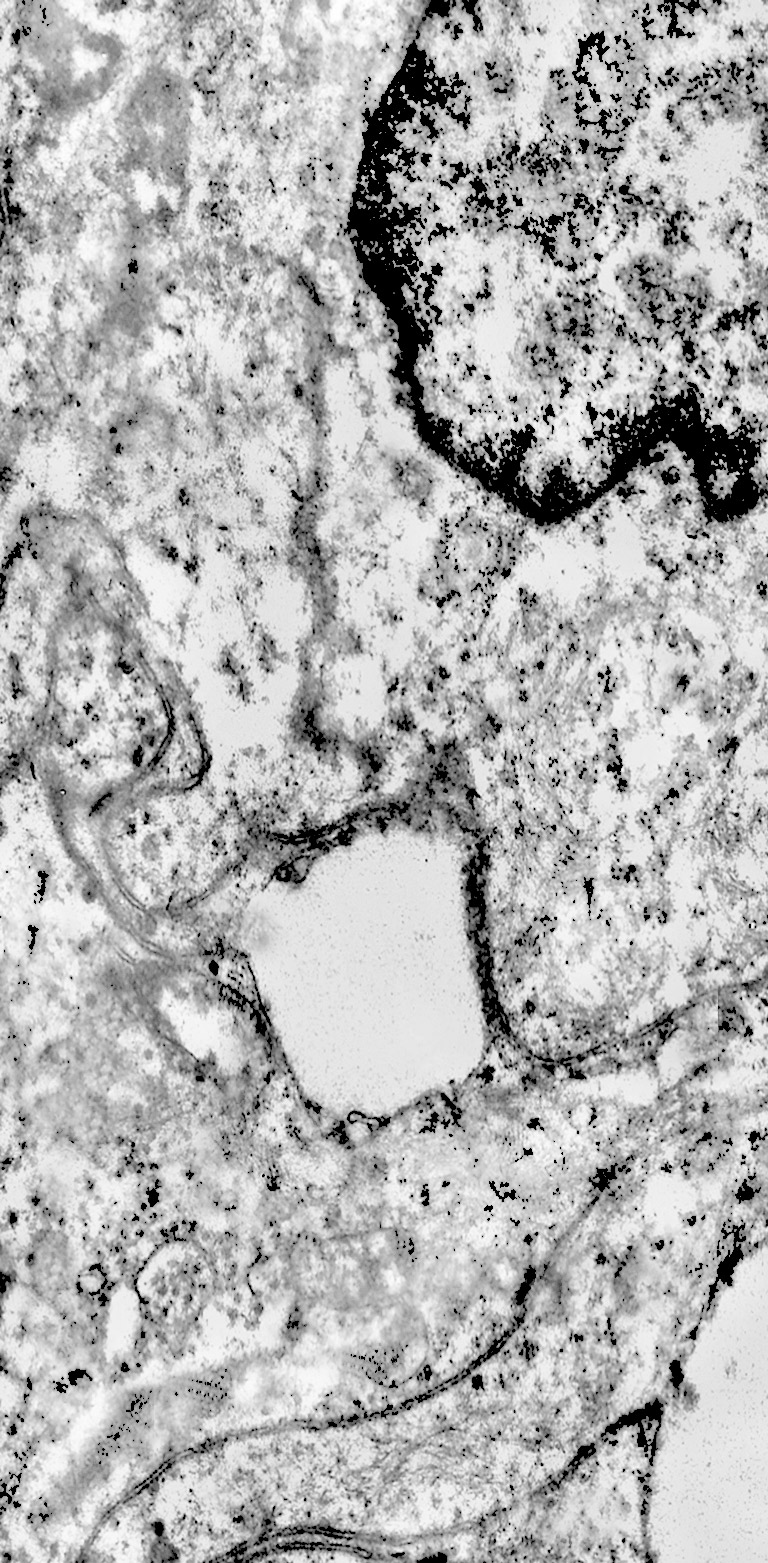
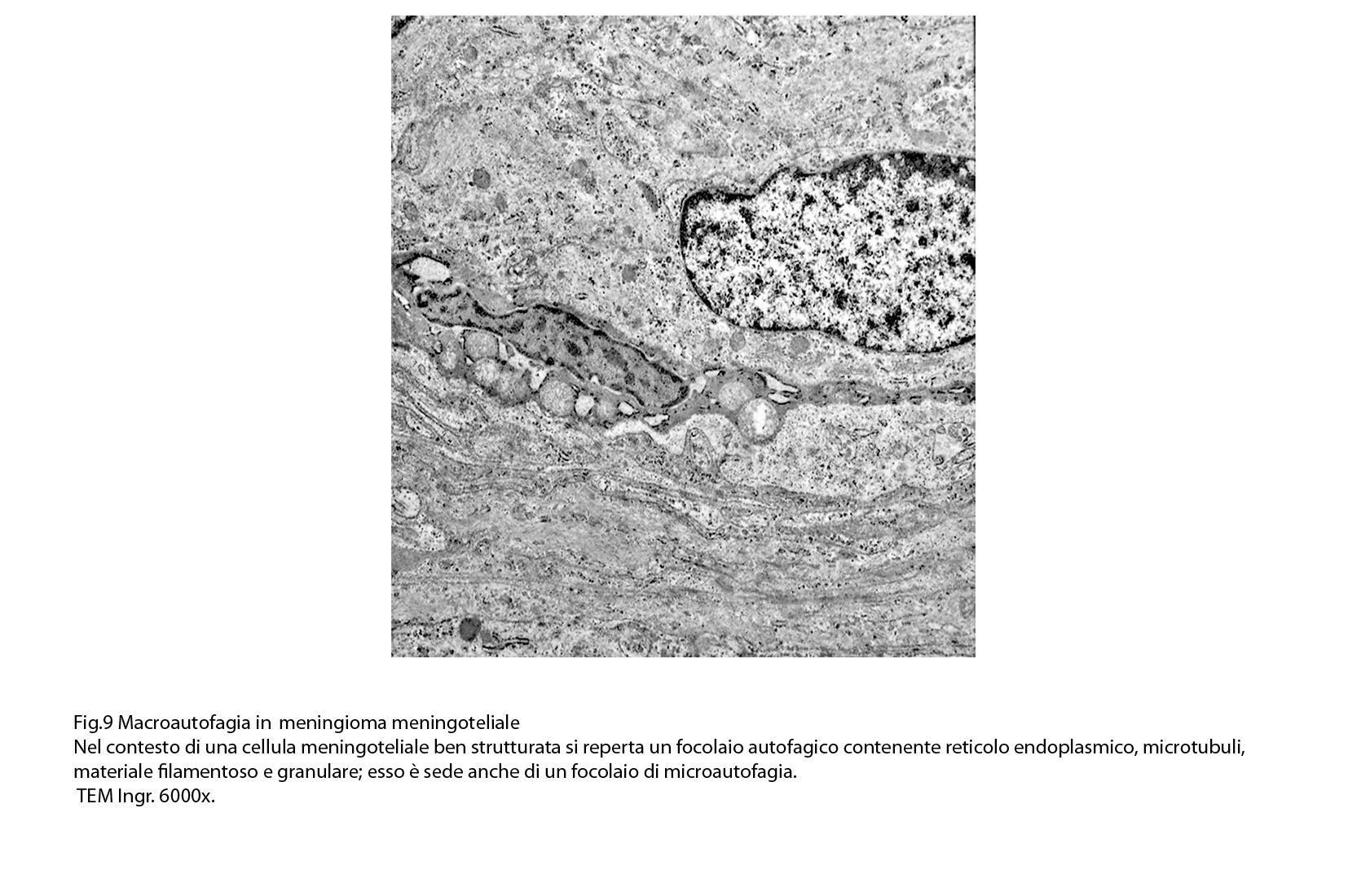
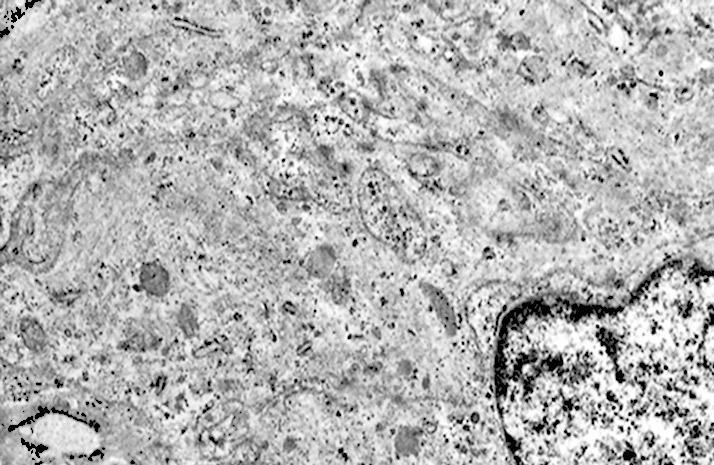
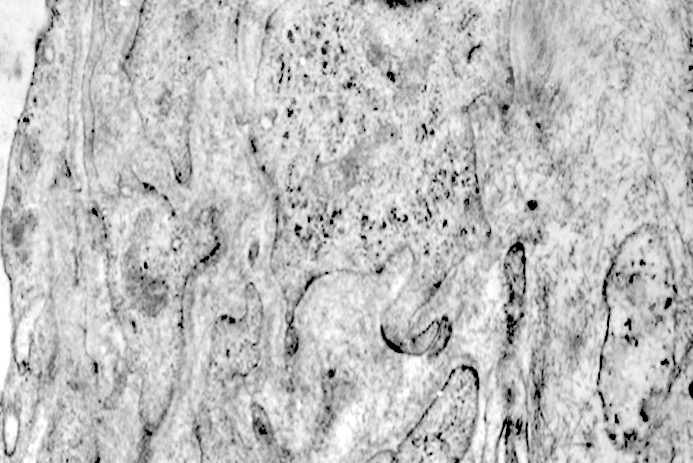
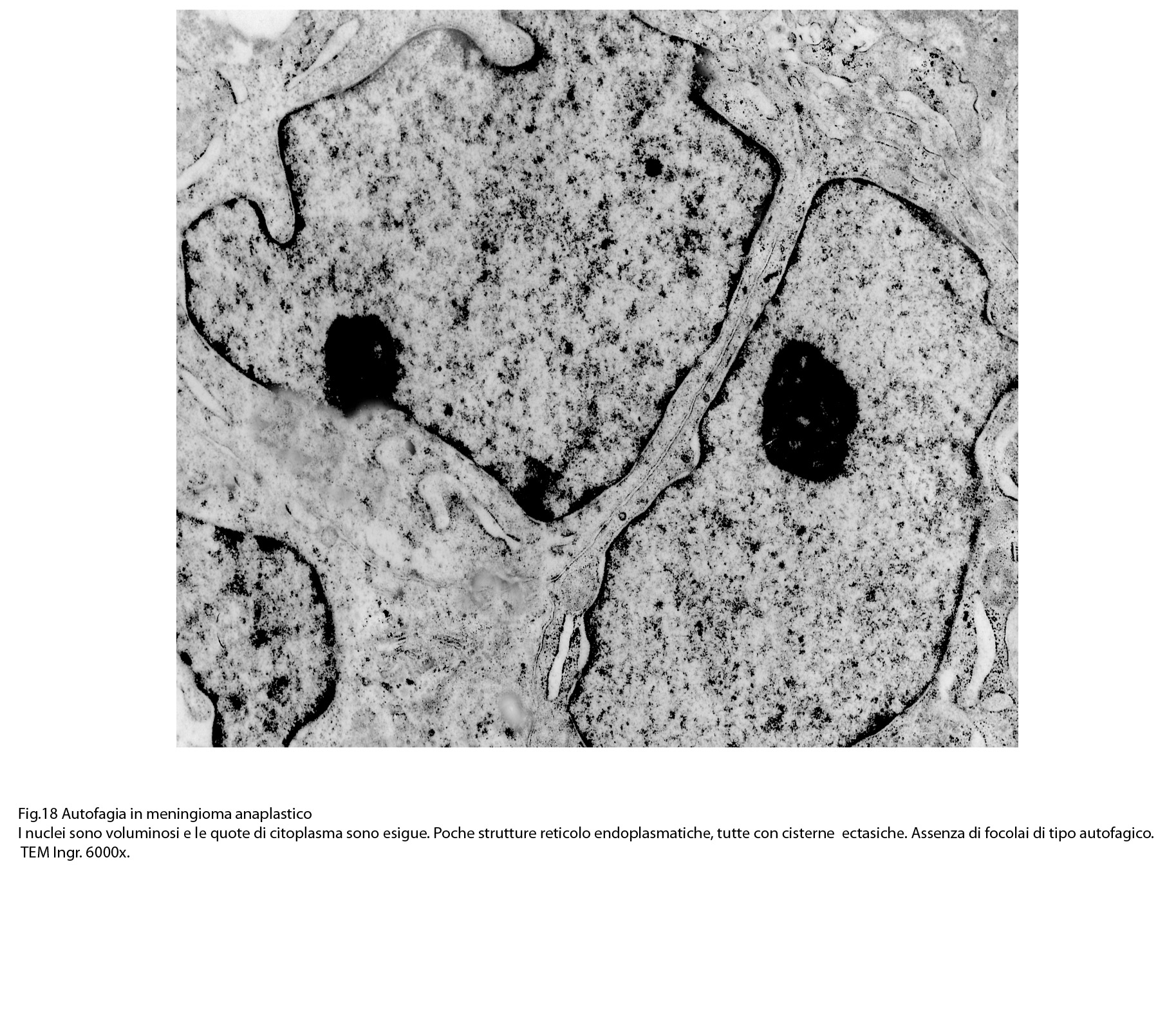
Al microscopio elettronico il citoplasma dei meningiomi meningoteliali appare ampio, ha un profilo irregolare, è fornito di prolungamenti citoplasmatici di varia lunghezza, ed è coeso alle cellule circostanti. Esso appare quasi sempre compatto anche se esibisce una densità del citosol molto variabile, fino ad immagini iperchiare, quasi trasparenti. E’ costantemente fornito di quote cospicue di organuli e di complessi proteici, e tutte queste substrutture sono distribuite in modo apparentemente uniforme nel citosol. Si evidenziano,infatti, numerosi quanto brevi segmenti di ergastoplasma rugoso, mitocondri piccoli, rotondeggianti e poveri di creste, reticolo endoplasmico liscio con cisterne ectasiche e apparentemente vuote, quote di ribosomi dispersi nel citosol, strutture di Golgi ben sviluppate, vescicole lisosomiali, numerosi microtubuli e quote variabili di filamenti intermedi variamente disposti in fascetti e orientati prevalentemente secondo l’asse maggiore della cellula. Il nucleo occupa una posizione centrale, ha un profilo irregolare, è voluminoso, è nucleolato ed ha un aspetto vescicoloso per la disposizione spaziale della cromatina lungo le fasce periferiche, a ridosso della membrana nucleare. Nel citoplasma di tali cellule si repertano in modo infrequente focolai non inerenti alla micro-architettura di tali elementi; essi sono distribuiti in modo apparentemente casuale e sono riconoscibili quali focolai di natura autofagica. Infatti, evidenziano una ultrastruttura formata da vescicole con gradi diversi di complessità e di ampiezza contenenti materiali diversi di natura biologica e organuli citoplasmatici. Su la base della complessità strutturale della loro morfologia si riconoscono focolai di microautofagia e di macro- autofagia in diversi stadi evolutivi.
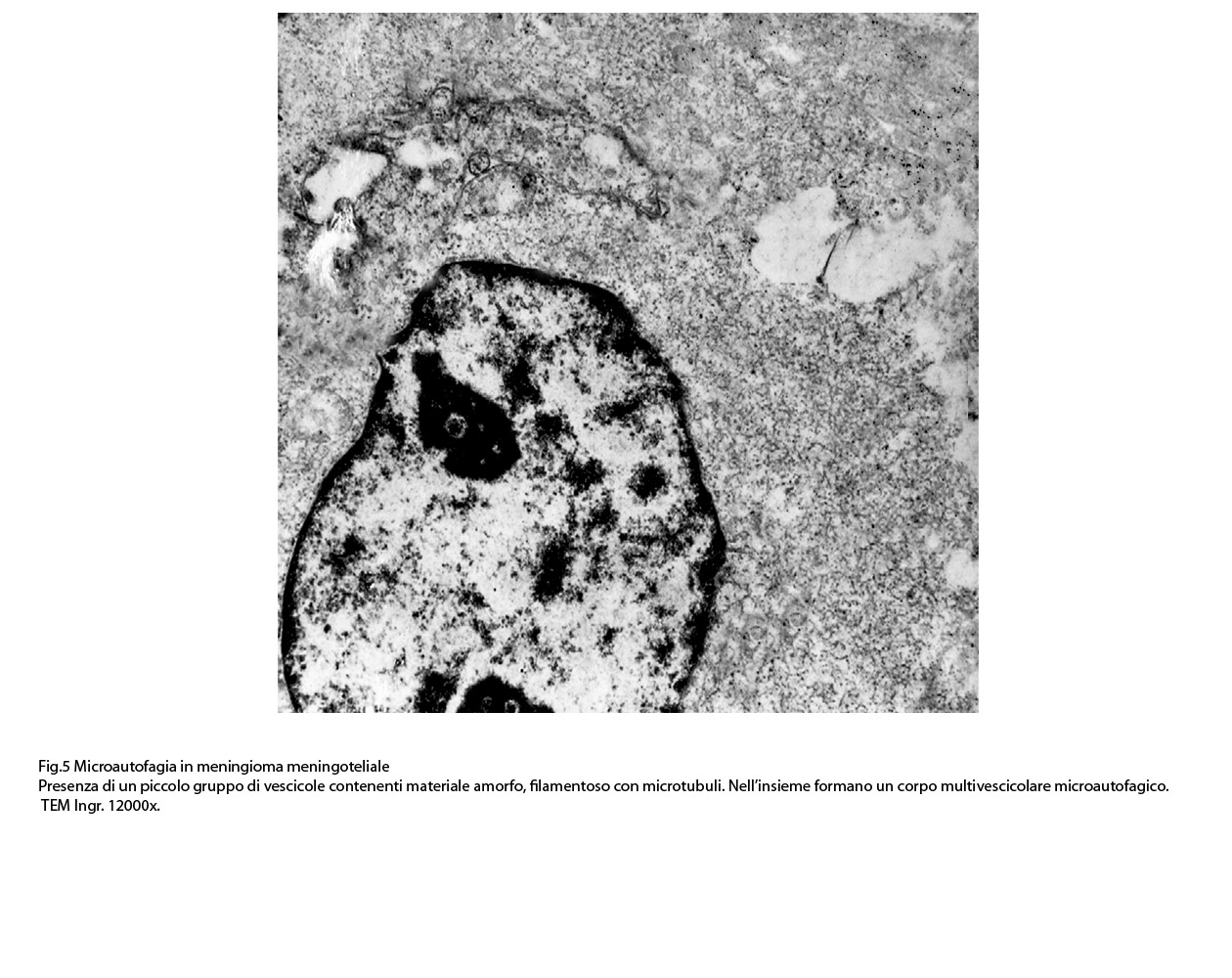
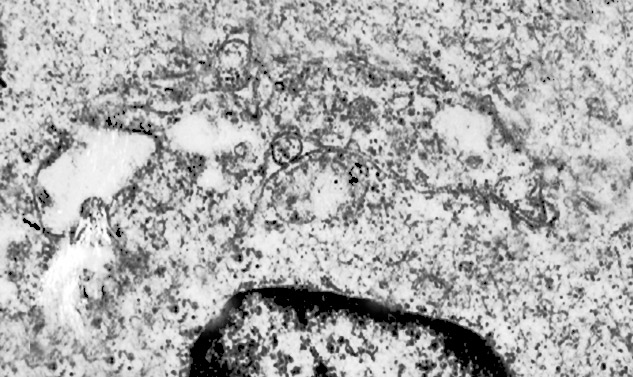
1) MICROAUTOFAGIA
Nel citosol si repertano vescicole di piccole dimensioni delimitate da una membrana di contorno a mono strato. Il loro lume è occupato da materiale amorfo e da corti filamenti distribuiti in modo disordinato.
Queste vescicole sono distribuite in modo irregolare, anzi casuale e si ritrovano ad essere isolate o riunite in piccoli aggregati formando un’immagine definita corpi multivescicolari.
Frequentemente questi focolai si ritrovano commisti ad altri aventi i caratteri della macroautofagia e sono in parte da questi mascherati. A parte questi particolari reperti,il citosol è occupato da numerosi mitocondri di piccole dimensioni e di forma rotondeggiante e di aspetto compatto,da ergastoplasma rugoso e da quote ben rappresentate di reticolo endoplasmico e di strutture lisosomiali.
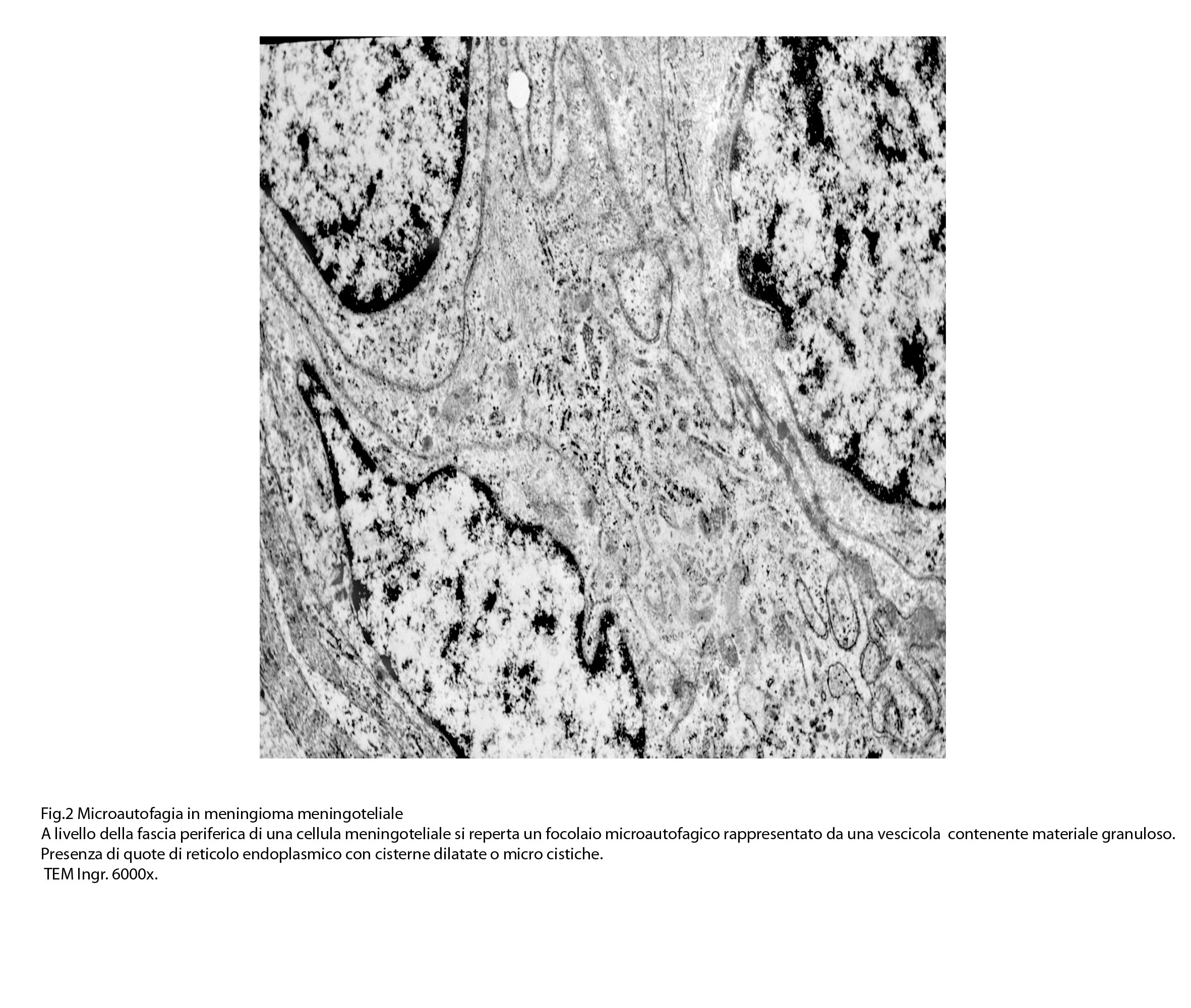
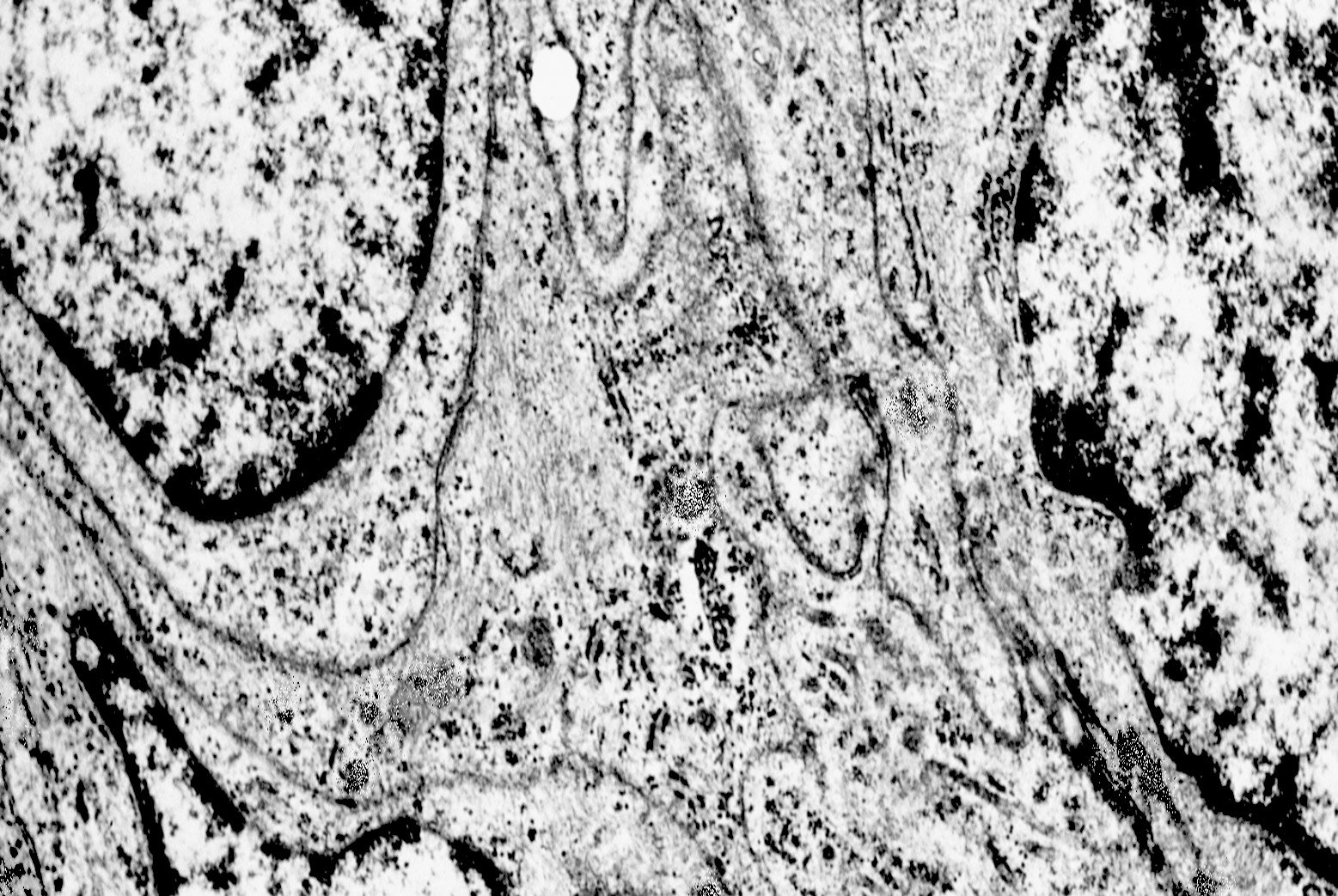
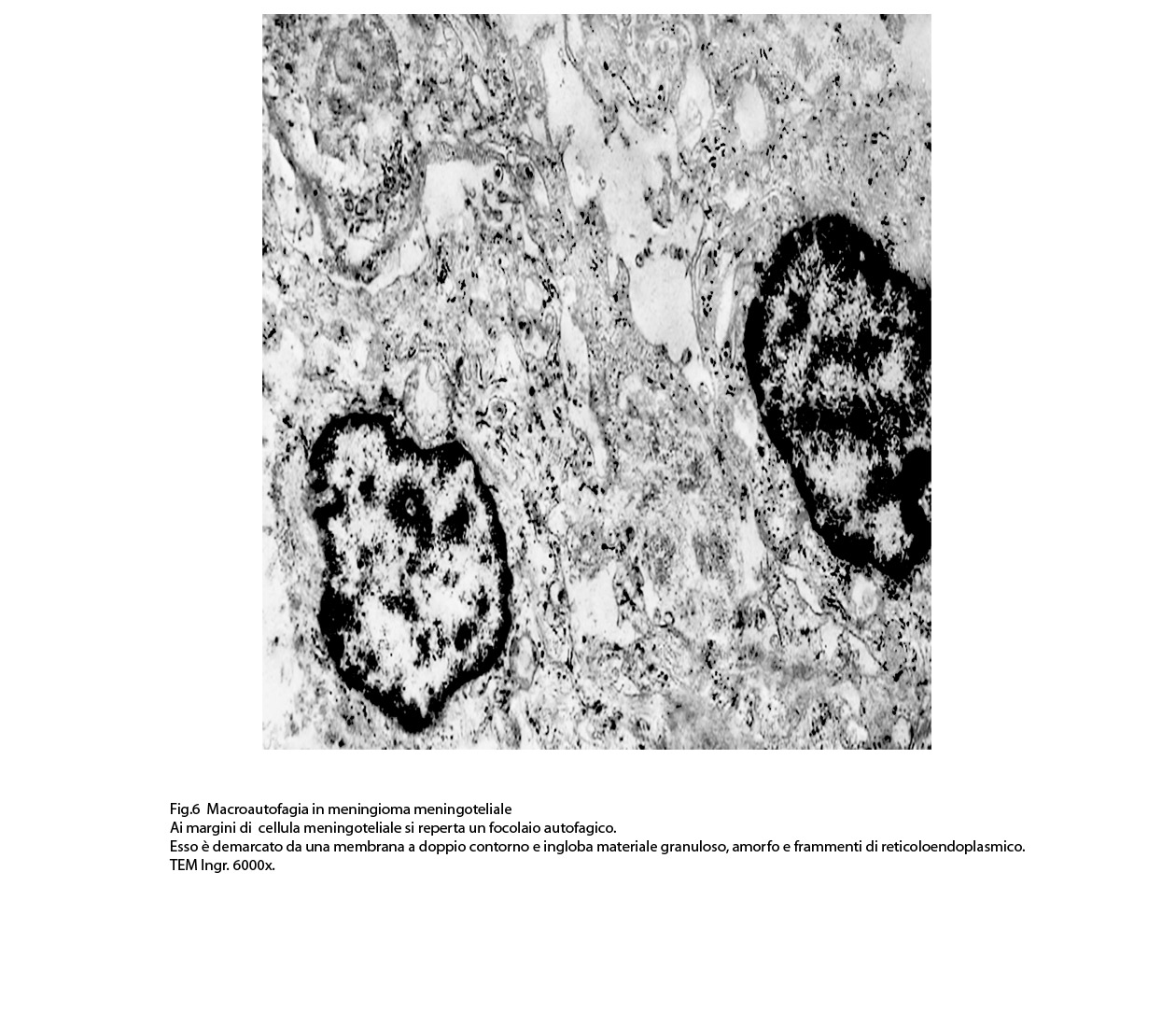
2) MACROAUTOFAGIA
La macroautofagia ,come sopra è stato fatto cenno,è un processo che si manifesta per stadi evolutivi; di questi, due sono, sul piano ultrastrutturale, diversi e sono indicati quali autofagosomi e auto lisosomi; pertanto la loro presentazione richiede i seguenti due distinti paragrafi:
2/a AUTOFAGOSOMA
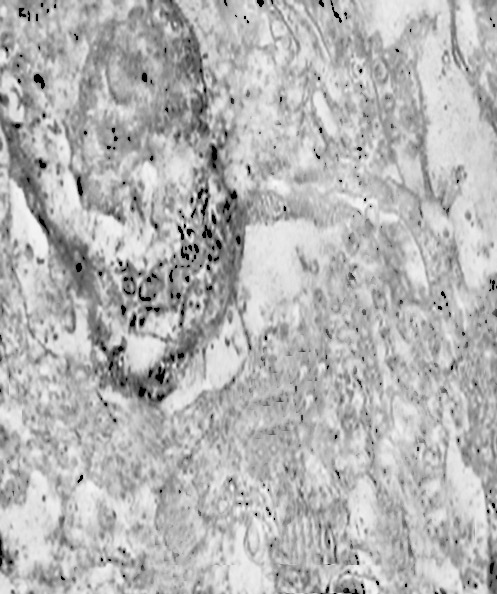
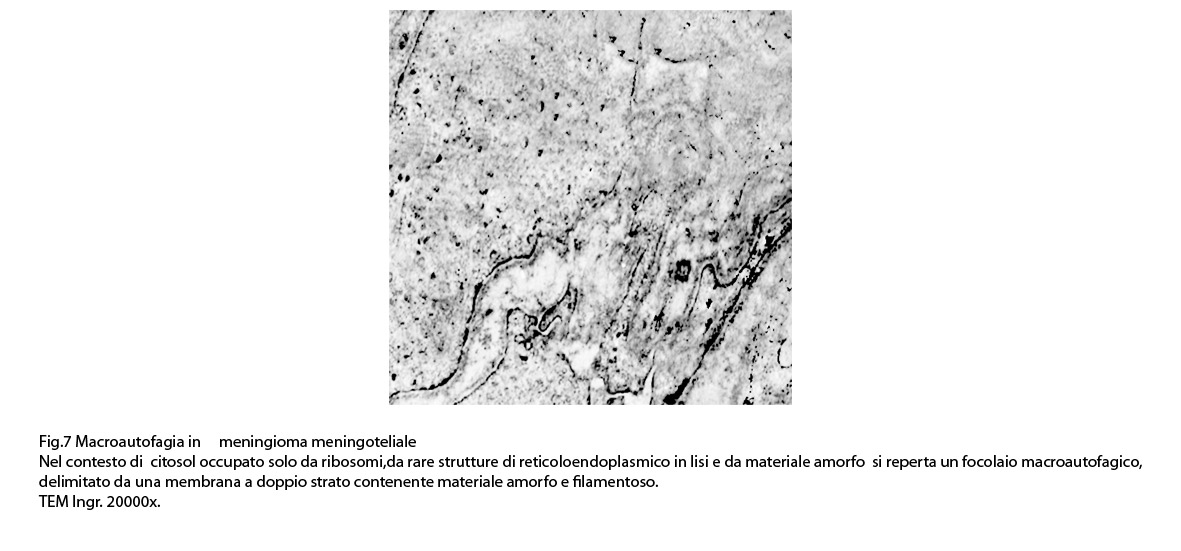
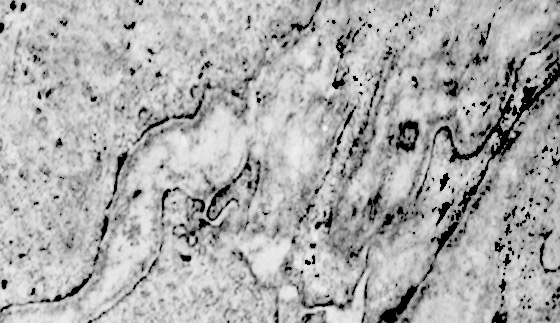
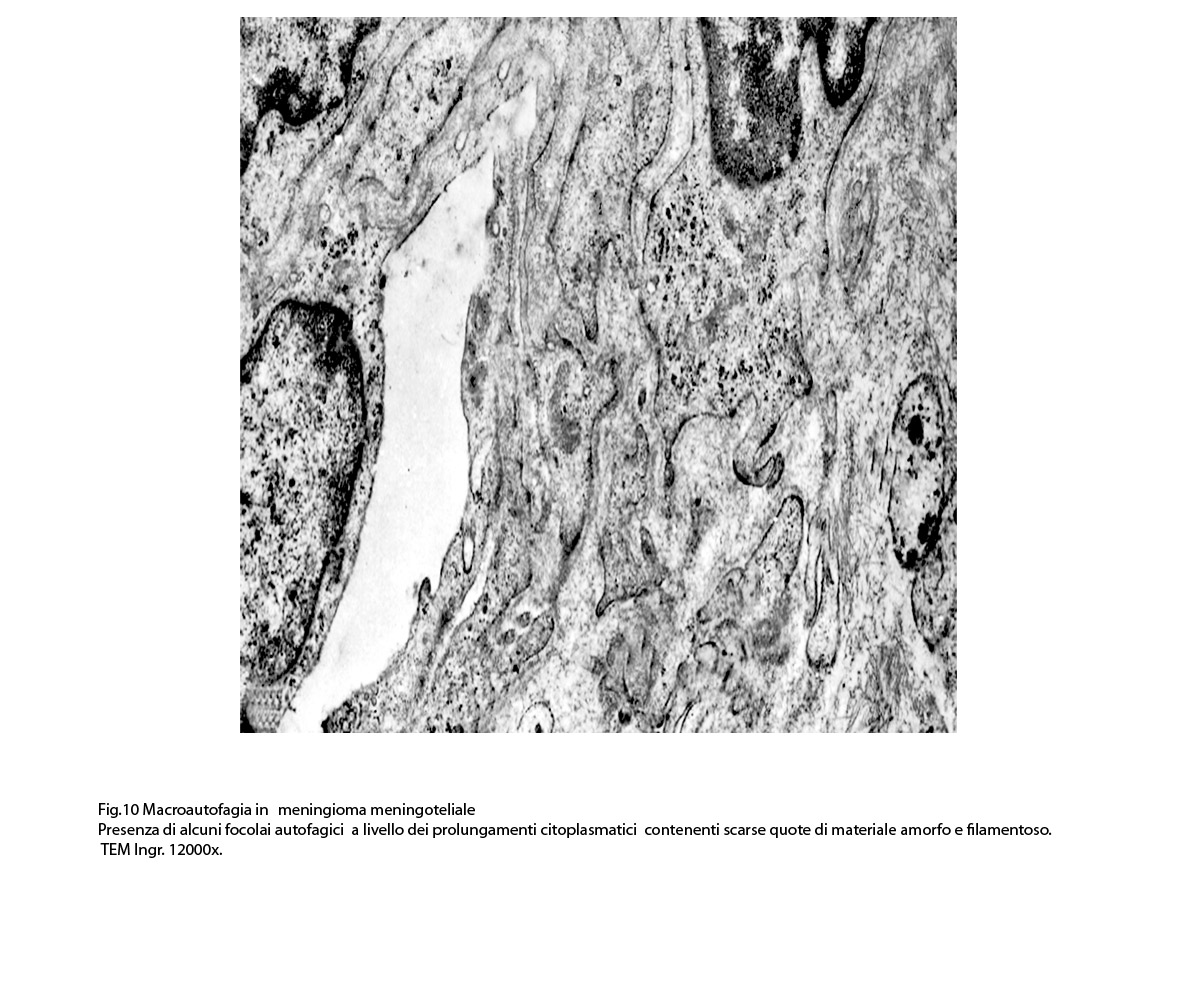
I focolai di macroautofagia possono essere presenti in zone diverse del citoplasma. La loro microstruttura di base è costituita da una area vacuolare demarcata da una membrana a doppio strato; l’area cava è occupata per quote variabili da materiale amorfo,da aggregati filamentosi,da frammenti di organuli,da gruppi granulosi, il tutto in diversi stati di conservazione. Questi focolai macroautofagici appaiono come strutture avulse dalle mutevoli condizioni bio-morfologiche del citoplasma nel quale si sono formate. E’ frequente il riscontro di cellule di aspetto cribroso per la esistenza di micro vacuoli scavati nel citosol e per la dilatazione delle cisterne del reticolo endoplasmico contengano nel citosol una formazione macroautofagica occupata in parte da materiale amorfo e filamentoso.
Non mancano elementi cellulari,forniti di un citosol contenente solo ribosomi liberi, rare strutture reticolo endoplasmatiche in via di disgregazione e molto materiale amorfo, essere occupati da un focolaio di macroautofagia con aggregati di filamenti.
Sono repertabili anche cellule meningoteliali ben strutturate e ricche di organuli marcate da un focolaio di autofagia contenente frammenti di substrutture e materiale filamentoso.
Anche a livello di prolungamenti citoplasmatici di cellule meningoteliali si riscontra la presenza di due focolai autofagici occupati in parte da materiale amorfo.
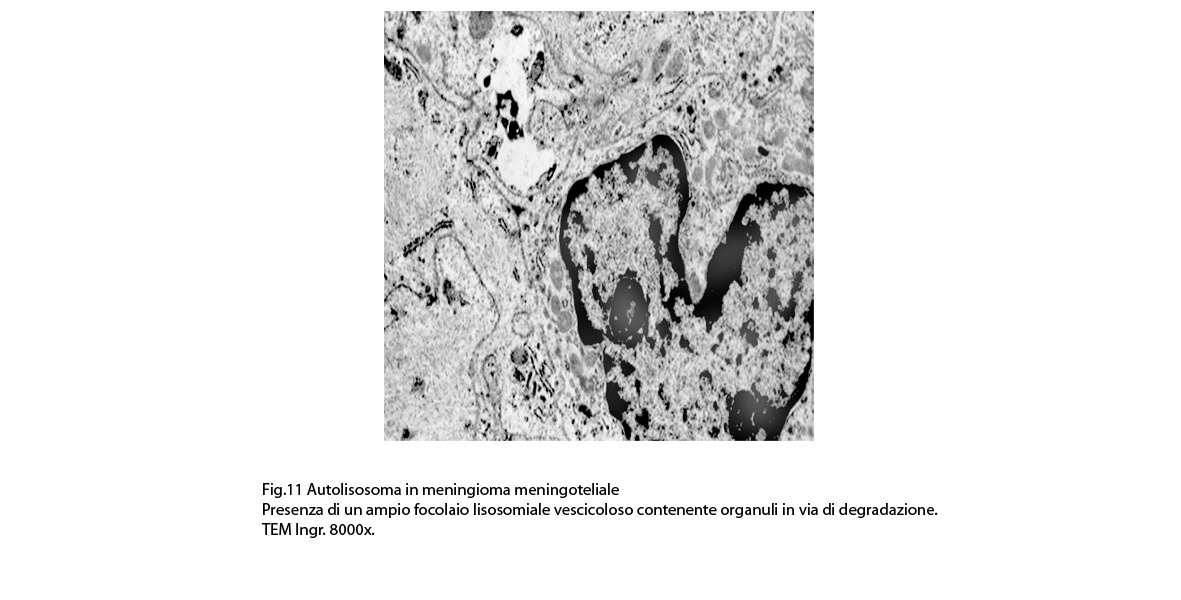
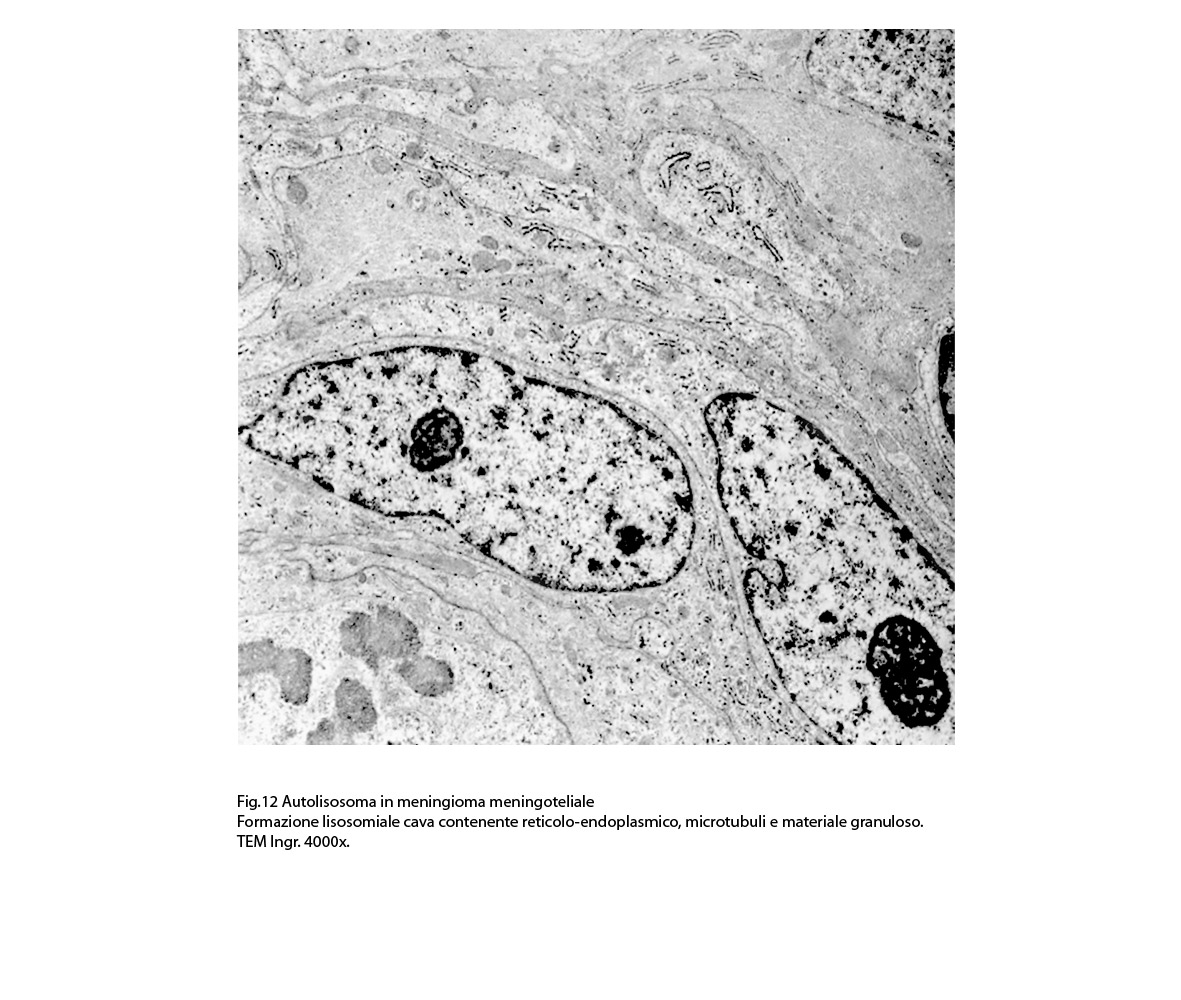
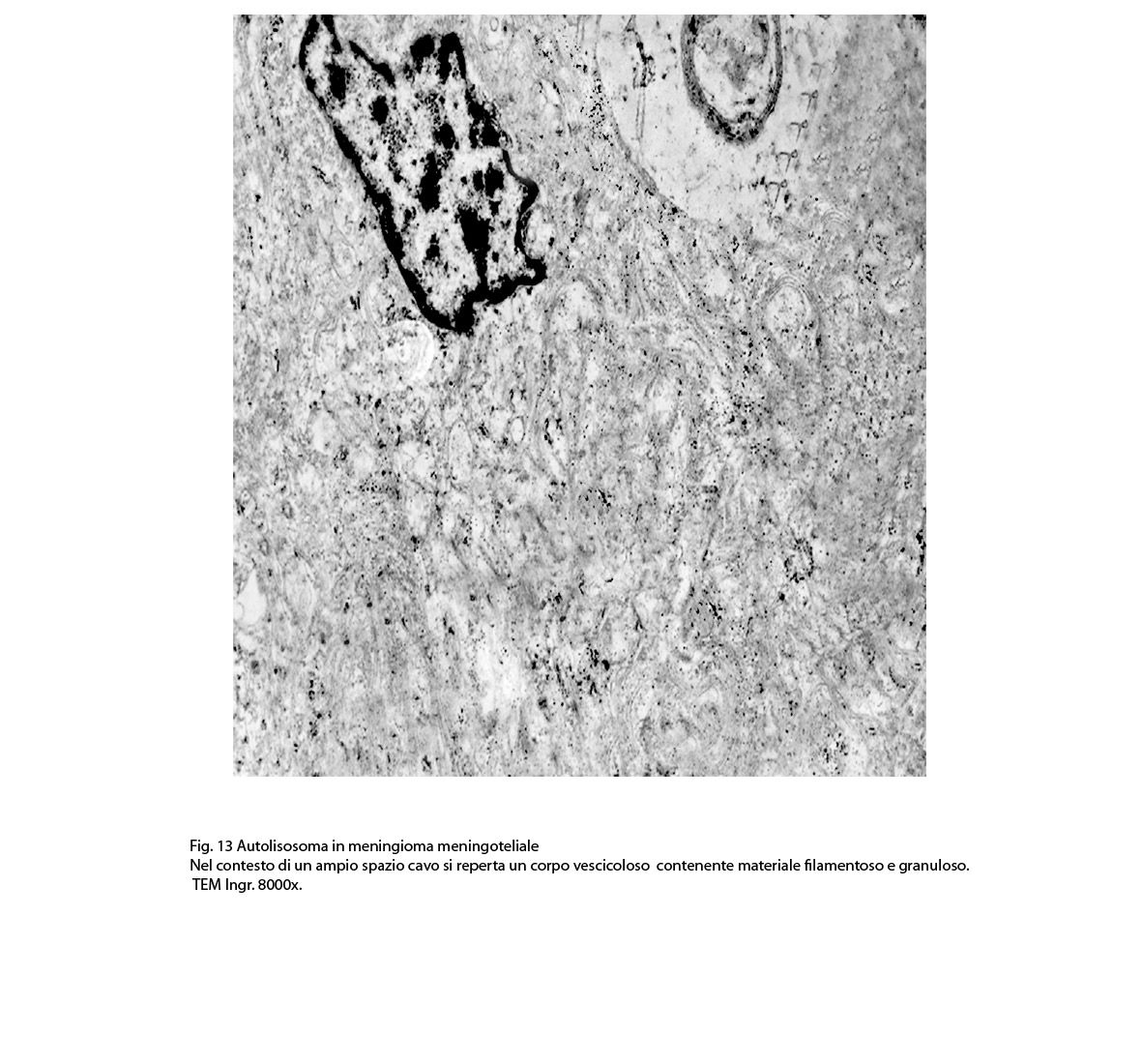
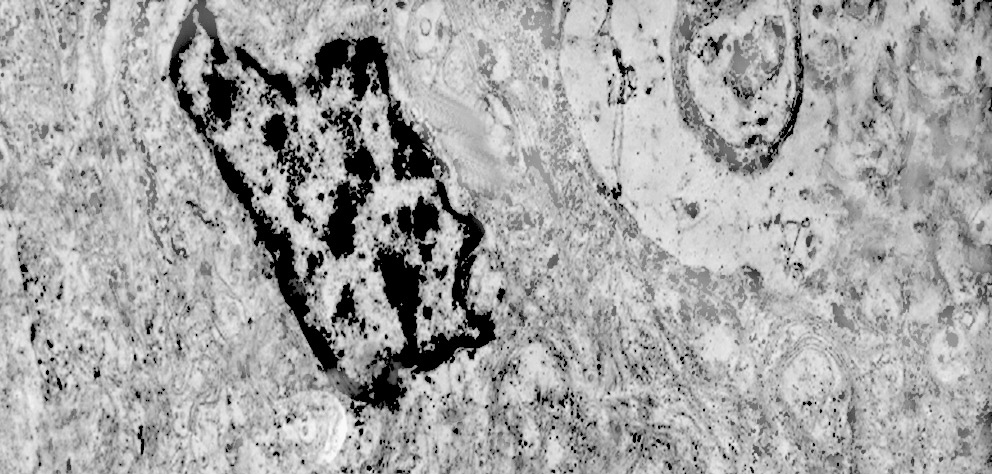
2/b AUTOLISOSOMA
Alcune cellule meningoteliali sono sedi, sopratutto a livello delle fasce periferiche, di ampie vescicole, di forma irregolare le quali sono demarcate da una membrana a mono-strato; gli spazi di queste vescicole sono in buona parte occupati da materiale amorfo, da frammenti filamentosi e da organuli intracitoplasmatici,tutto sottoposto a degradazione.
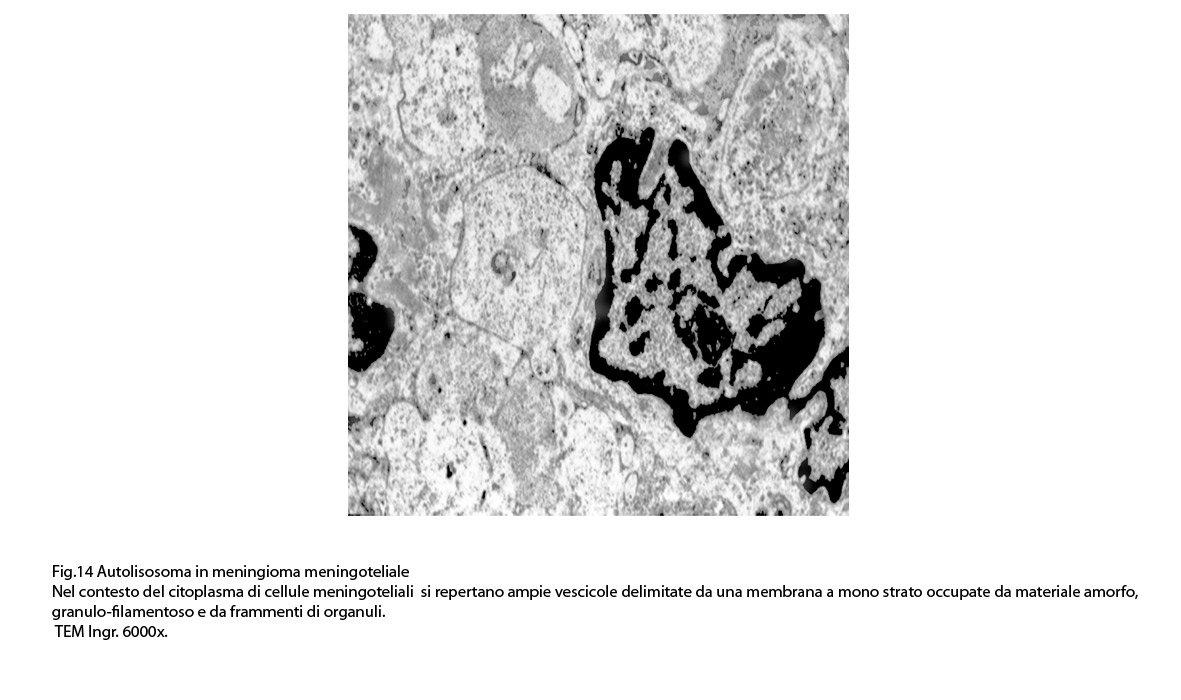
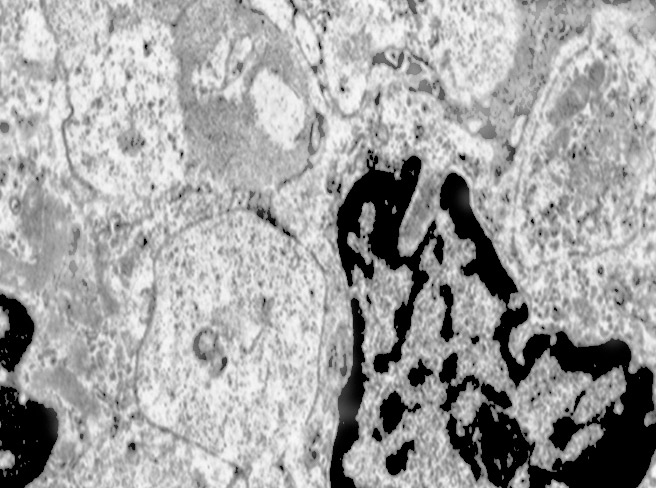
E’ possibile anche il reperto di elementi cellulari aventi il citoplasma occupato da ampie vescicole,delimitate da una membrana a monostrato, le quali sono ricolme di materiale amorfo,da strutture granulo-filamentose o da frammenti di organuli.
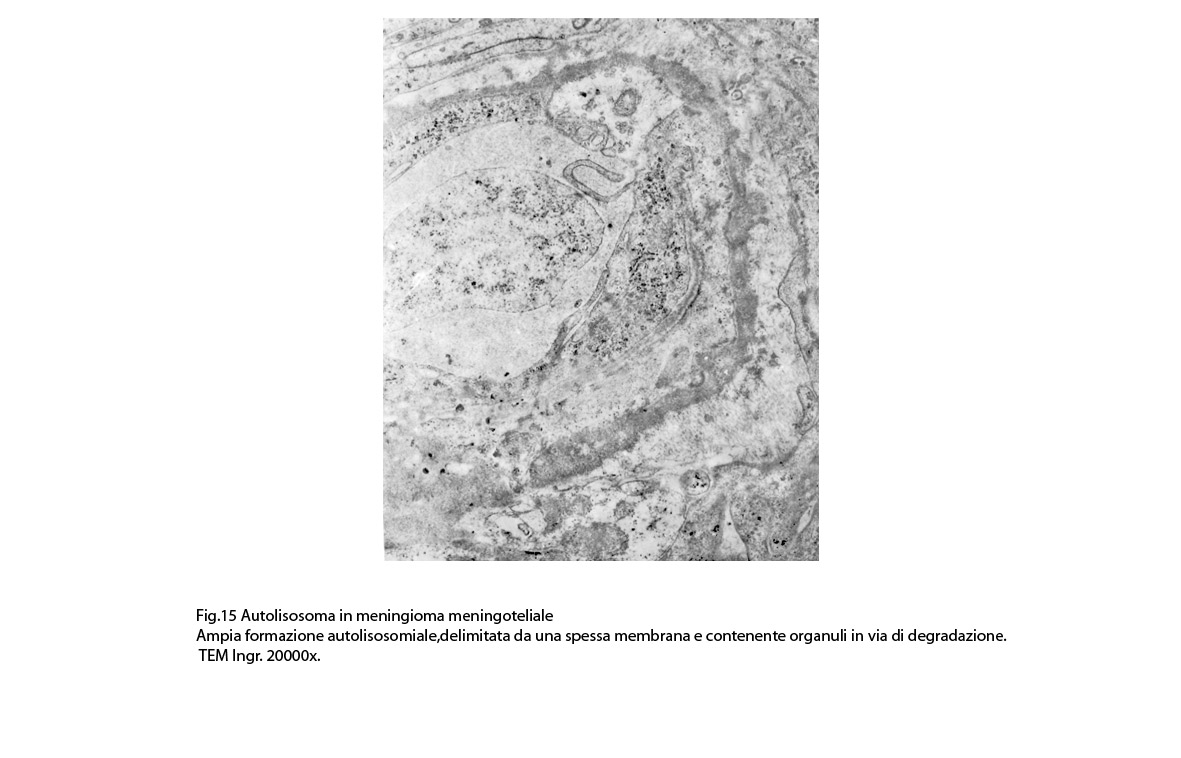
Non è raro il riscontro di cellule meningoteliali le quali hanno il citoplasma in buona parte occupato da una formazione cava,irregolarmente rotondeggiante; questa è delimitata da una spessa membrana ed è occupata da frammenti di citoplasma e da singoli organuli,tutto in corso di degradazione.
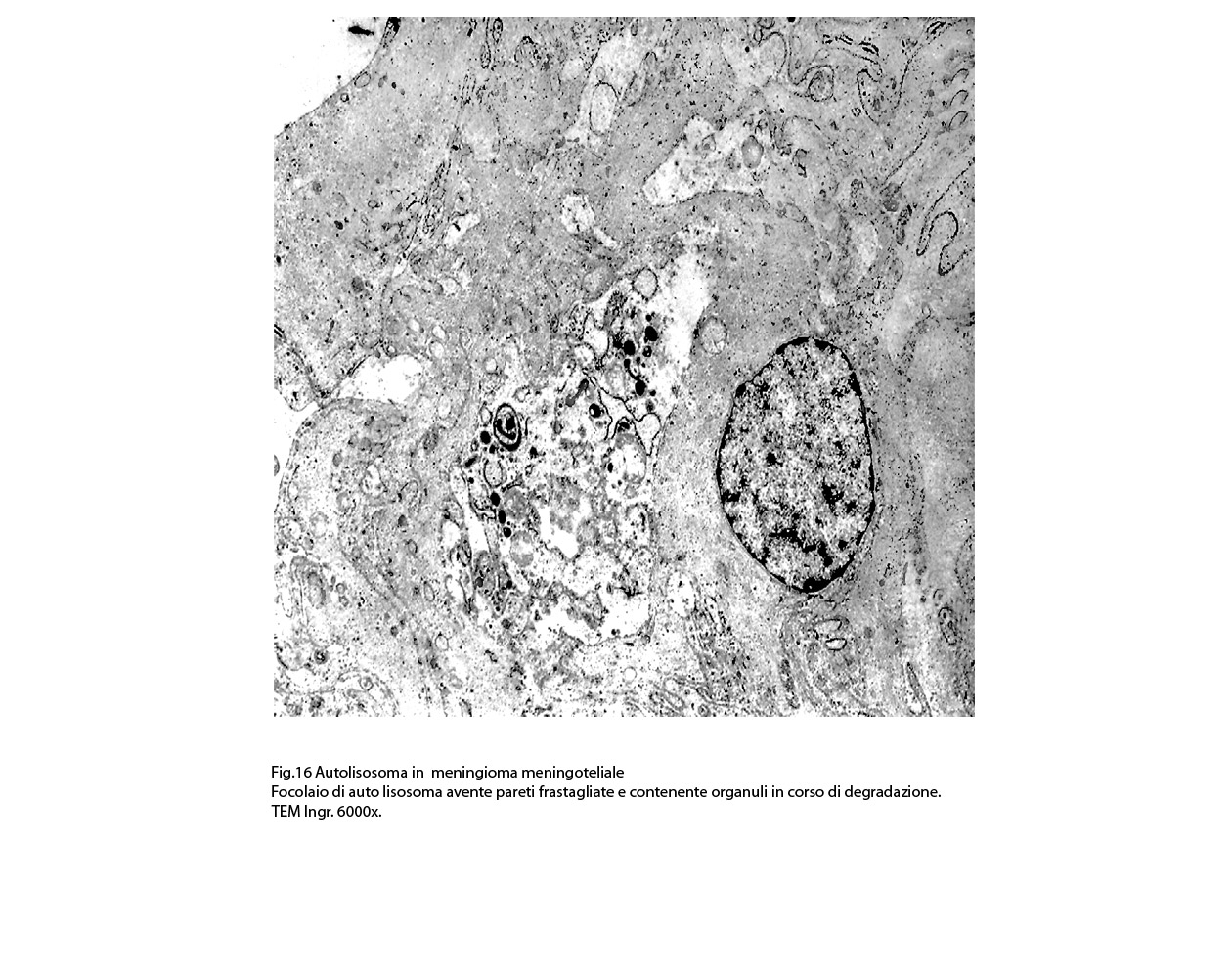
Nel contesto di alcune cellule coese,tutte contenenti focolai di micro e macroautofagia,è possibile rintracciare una di esse la quale è occupata da una ampia vescicola,a pareti frastagliate e lacerate, quasi ricolma di organuli e materiale filamentoso. Il citosol di tutte queste cellule è iperchiaro e gli organuli ivi contenuti sono in numero esiguo e mostrano segni morfologici di necrobiosi.
B) FOCOLAI DI AUTOFAGIA IN MENINGIOMI ANAPLASTICI
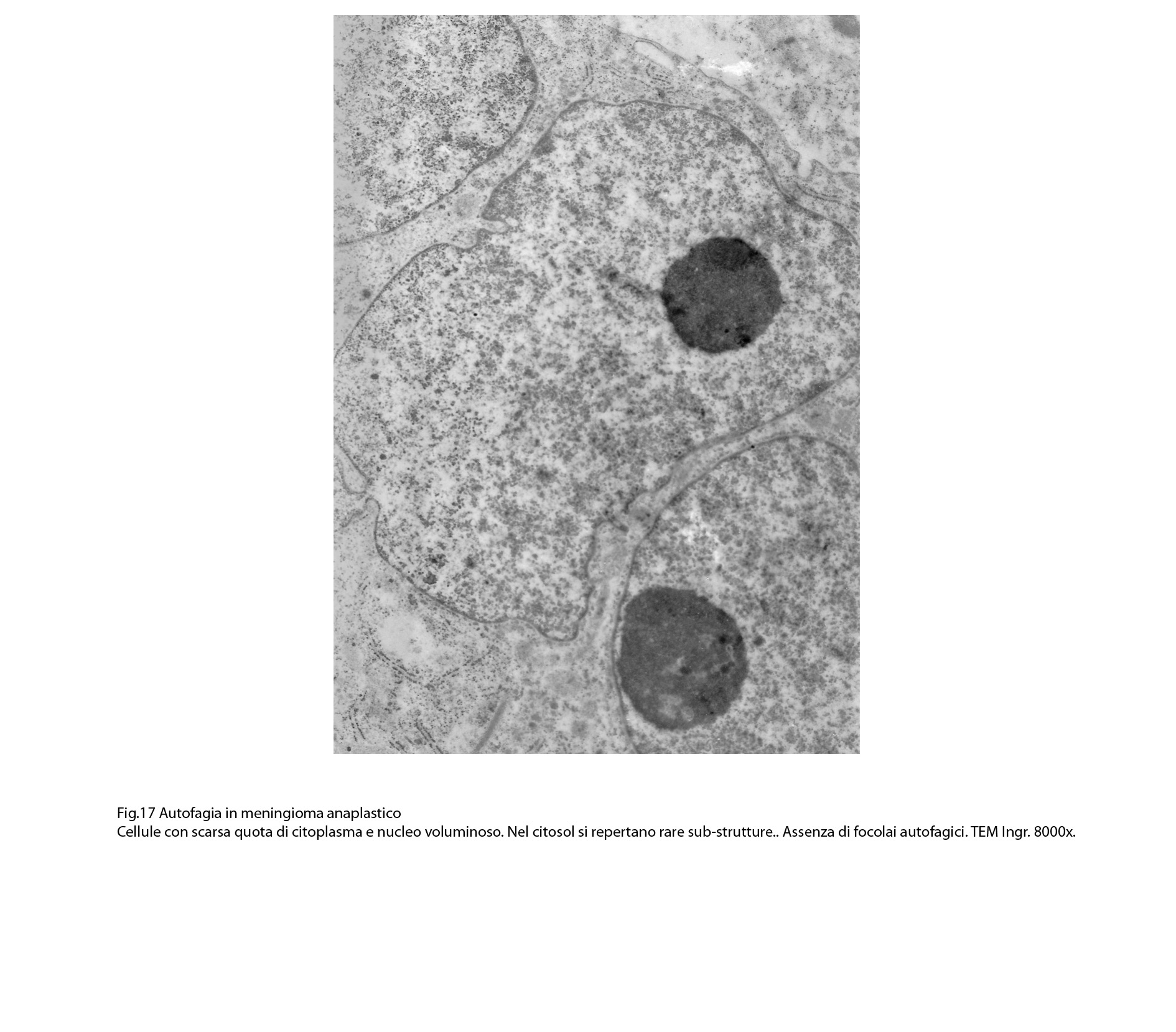
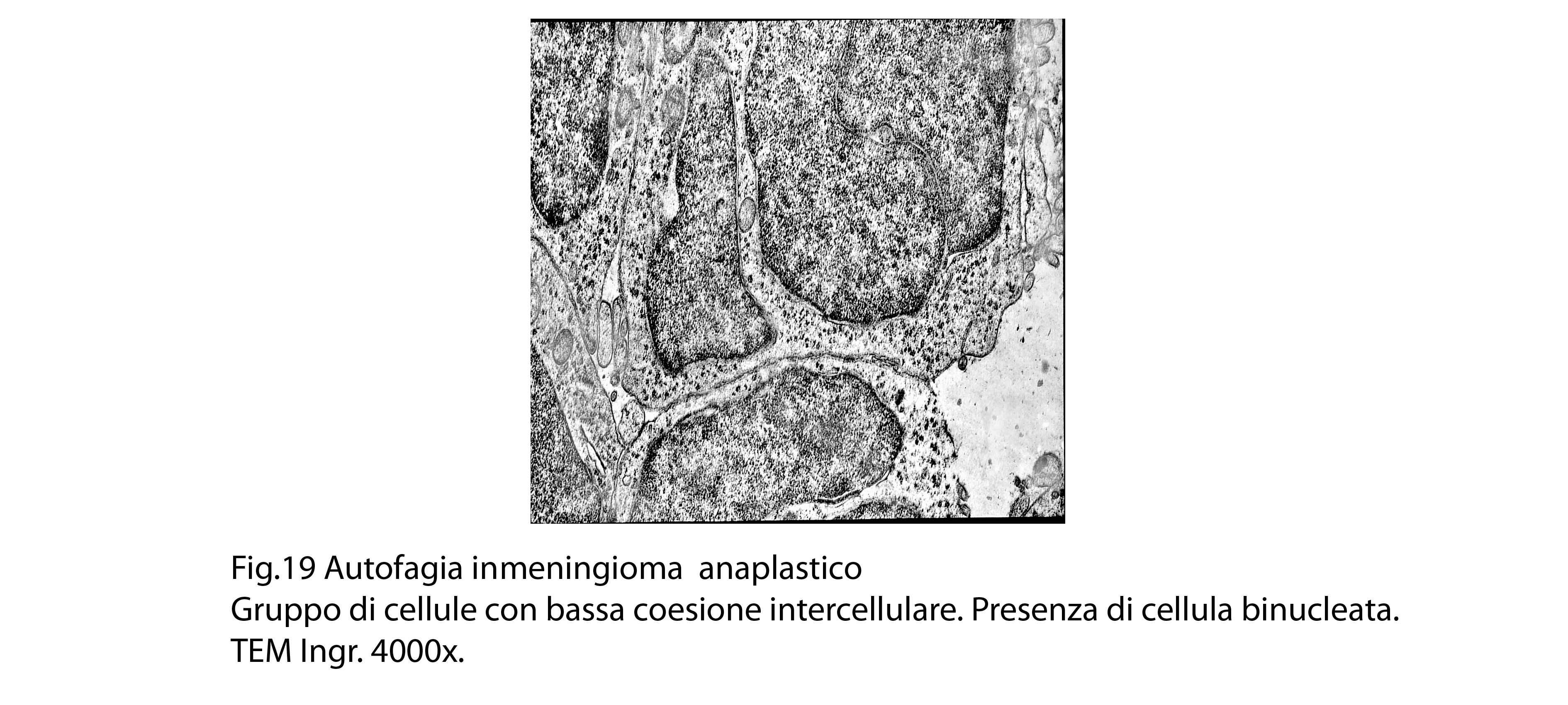
La popolazione cellulare dei meningiomi anaplastici è data da elementi di piccole e medie dimensioni che si dispongono spazialmente in aggregati informi. Ciascuno di essi ha una forma irregolarmente cuboide o poligonale e soprattutto è caratterizzato da una esigua quota citoplasmatica esigua e da una voluminosa massa nucleare.
Al microscopio elettronico,il citoplasma appare compatto ed il citosol contiene pochi mitocondri, scarso reticolo endoplasmatico ed ergastoplasma, discrete quote di ribosomi liberi e di microtubuli.
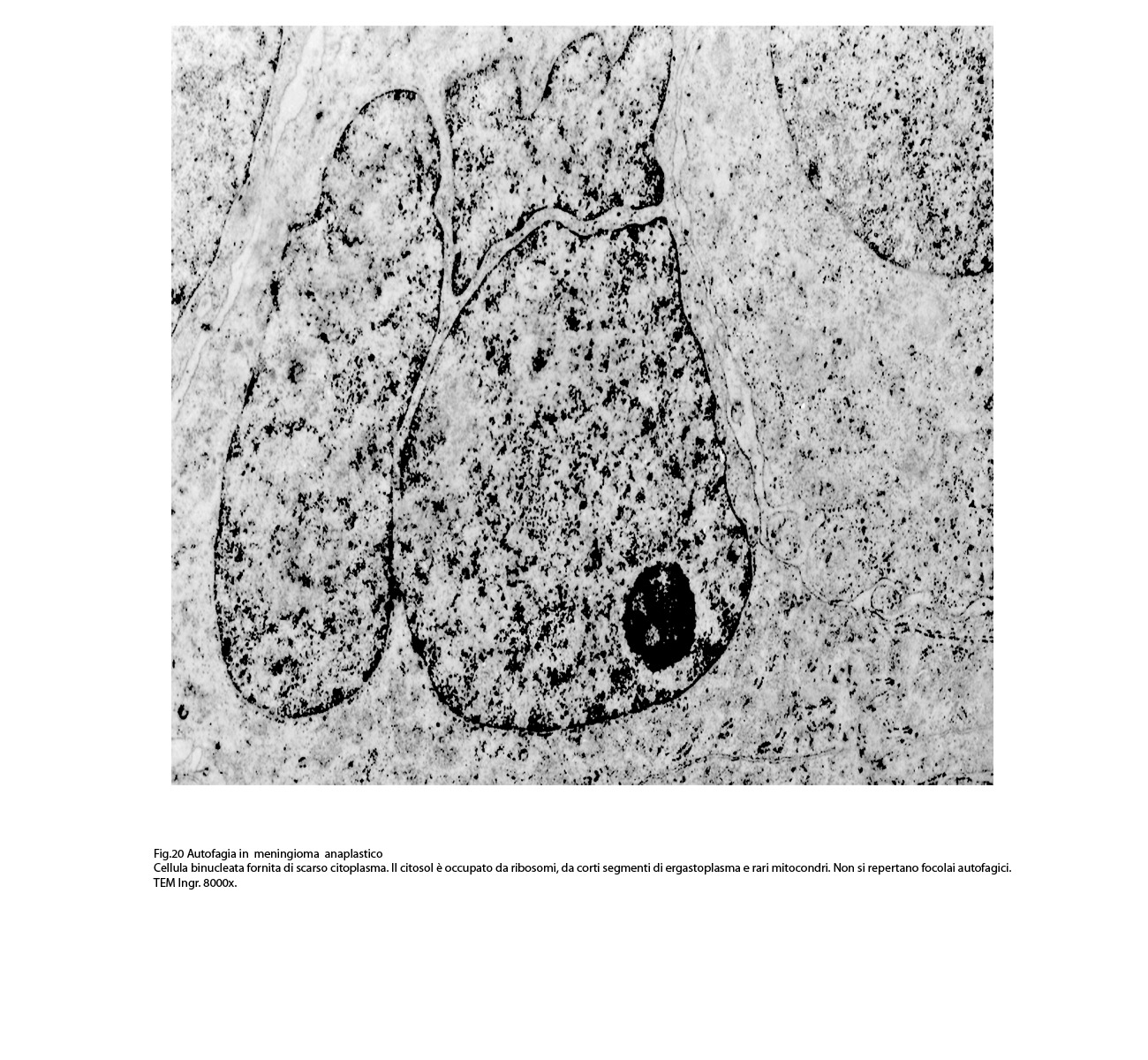
Molto frequentemente si riscontrano elementi i quali evidenziano una condizione di cellula binucleata.
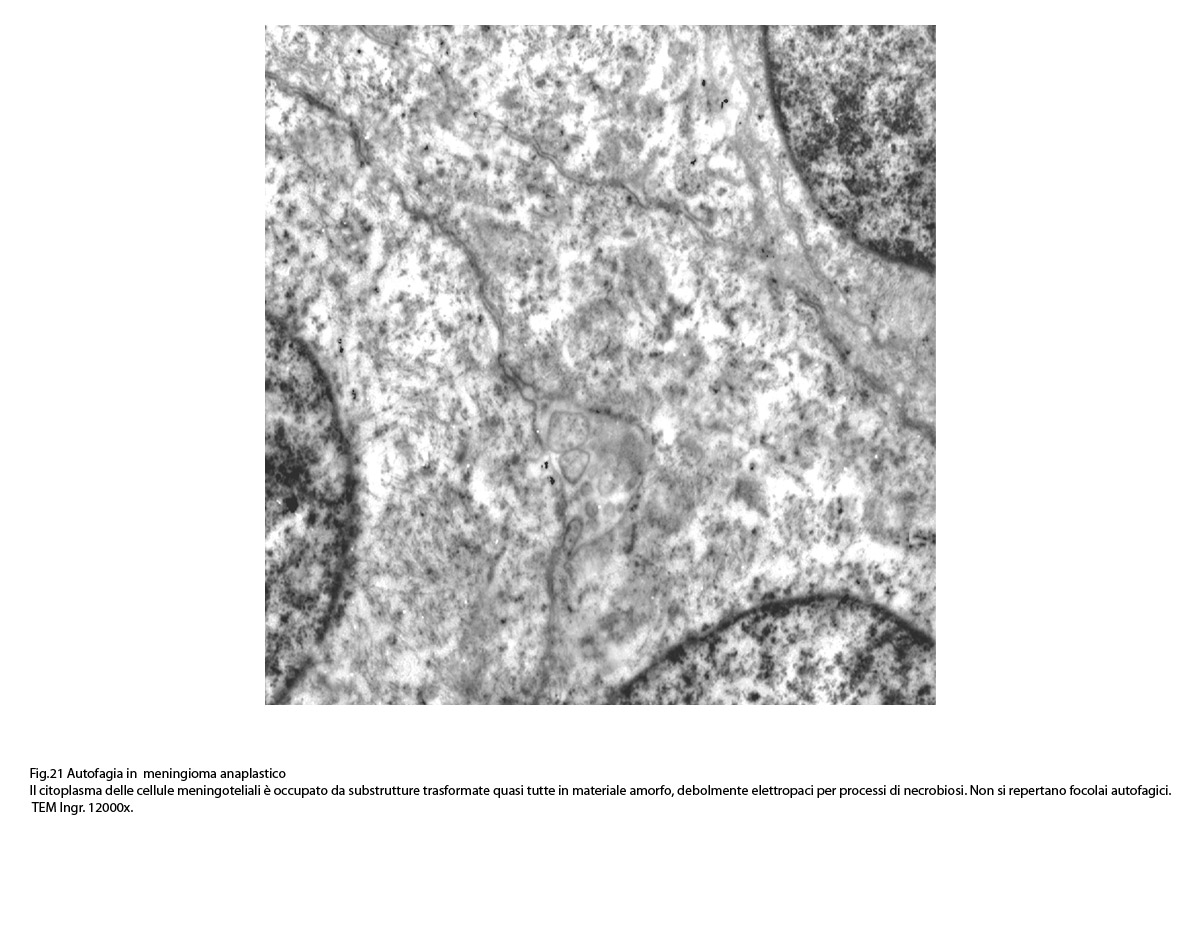
Non mancano elementi caratterizzati da un citoplasma trasformato in piccoli ammassi informi per processi di necrobiosi.
Le numerose osservazioni ultrastrutturali condotte su casi di meningiomi anaplastici hanno evidenziato in modo ripetitivo gli abituali caratteri di cellule con tale morfologia e in nessun campo hanno evidenziato focolai riferibili a processi di autofagia.
CONCLUSIONE
I reperti dianzi descritti e documentati indicano la esistenza di focolai di autofagia nei meningiomi benigni; reperti questi non riscontrati nei meningiomi maligni. Questi dati, ripetitivi, non trovano a livello morfologico una spiegazione soddisfacente. Se si rimane nel perimetro delle osservazioni descrittive è possibile sottolineare una differenza incontrovertibile: La ultrastruttura del citoplasma dei meningiomi meningoteliali benigni è sostanzialmente diversa da quella dei meningiomi maligni. I primi sono ricchi di organuli e di substrutture e sono frequenti le disfunzioni mitocondriali e lo stress del reticolo endoplasmico, quali fattori avvianti il meccanismo dell’autofagia. Al contrario, i meningiomi maligni sono forniti di quote esigue di organuli (con prevalenza soltanto di microtubuli e ribosomi),e probabilmente non sono esposti a intrinseche disfunzioni o alterazioni endocellulari atte a indurre l’autofagia.